
ЁОЬтФПЁПЁАЕЭЬМбЛЗЁБв§Ц№ИїЙњЕФИпЖШжиЪгЃЌвбжЊУКЁЂМзЭщЕШПЩвдгыЫЎеєЦјЗДгІЩњГЩвдCOКЭH2ЮЊжїЕФКЯГЩЦјЃЌКЯГЩЦјгаЙуЗКгІгУЃЎЪдЛиД№ЯТСаЮЪЬтЃК
(1)ИпТЏСЖЬњЪЧCOЦјЬхЕФживЊгУЭОжЎвЛЃЌЦфЛљБОЗДгІЮЊЃКFeO(s)+CO(g)![]() Fe(s)+CO2(g) ЁїHЃО0ЁЃвбжЊдк1100ЁуCЪБЃЌИУЗДгІЕФЛЏбЇЦНКтГЃЪ§K=0.263ЁЃ
Fe(s)+CO2(g) ЁїHЃО0ЁЃвбжЊдк1100ЁуCЪБЃЌИУЗДгІЕФЛЏбЇЦНКтГЃЪ§K=0.263ЁЃ
ЂйЮТЖШЩ§ИпЃЌЦНКтвЦЖЏКѓДяЕНаТЦНКтЃЌДЫЪБЦНКтГЃЪ§жЕ____(ЬюЁАдіДѓЁБЁАМѕаЁЁБЁАВЛБфЁБ)ЃЛ
Ђк1100ЁуCЪБВтЕУИпТЏжаЃЌc(CO2)=0.025molЁЄLЉ1ЃЌc(CO)=0.1molЁЄLЉ1ЃЌдђдкетжжЧщПіЯТЃЌИУЗДгІетвЛЪБПЬЯђ_______Нјаа(ЬюЁАзѓЁБЛђЁАгвЁБ)ЁЃ
(2)ФПЧАЙЄвЕЩЯвВПЩгУCO2РДЩњВњШМСЯМзДМCH3OHЃЌгаЙиЗДгІЮЊЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЃЌЁїH=Љ49.0KJmolЉ1ЃЌФГЮТЖШЯТЃЌЯђЬхЛ§ЮЊ1LКуШнУмБеШнЦїжаЃЌГфШы1molCO2КЭ3molH2ЃЌЗДгІЙ§ГЬжаВтЕУCO2КЭCH3OH(g)ЕФХЈЖШЫцЪБМфЕФБфЛЏШчЭМЫљЪОЃЎ
CH3OH(g)+H2O(g)ЃЌЁїH=Љ49.0KJmolЉ1ЃЌФГЮТЖШЯТЃЌЯђЬхЛ§ЮЊ1LКуШнУмБеШнЦїжаЃЌГфШы1molCO2КЭ3molH2ЃЌЗДгІЙ§ГЬжаВтЕУCO2КЭCH3OH(g)ЕФХЈЖШЫцЪБМфЕФБфЛЏШчЭМЫљЪОЃЎ
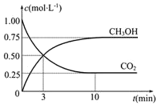
ЂйЗДгІПЊЪМжСЦНКтЃЌЧтЦјЕФЦНОљЗДгІЫйТЪv(H2)=______ЃЌCO2ЕФзЊЛЏТЪЮЊ_____ЃЛИУЮТЖШЯТЩЯЪіЗДгІЕФЦНКтГЃЪ§K=_____(ЗжЪ§БэЪО)ЃЛ
ЂкЗДгІДяЕНЦНКтКѓЃЌЯТСаФмЪЙ![]() ЕФжЕдіДѓЕФДыЪЉЪЧ______(ЬюЗћКХ)ЁЃ
ЕФжЕдіДѓЕФДыЪЉЪЧ______(ЬюЗћКХ)ЁЃ
aЃЎЩ§ИпЮТЖШ bЃЎдйГфШыH2 cЃЎдйГфШыCO2 dЃЎНЋH2O(g)ДгЬхЯЕжаЗжРы eЃЎГфШыHe(g)
ЂлгаШЫЬсГіЃЌПЩвдЩшМЦЗДгІ2CO(g)=2C(s)+O2(g) (ЁїHЃО0)РДЯћГ§COЕФЮлШОЃЌЧыФуХаЖЯЩЯЪіЗДгІЪЧЗёФмздЗЂНјааВЂЫЕУїРэгЩ________ЁЃ
ЁОД№АИЁПдіДѓ гв 0.225 molЁЄЃЈLЁЄminЃЉ-1 75% ![]() L2/mol2 bd ВЛФмЃЌвђЮЊИУЗДгІЕФЁїHЃО0ЃЌЁїS<O ЁїH-TЁїSЃО0ЃЌВЛФмздЗЂНјаа
L2/mol2 bd ВЛФмЃЌвђЮЊИУЗДгІЕФЁїHЃО0ЃЌЁїS<O ЁїH-TЁїSЃО0ЃЌВЛФмздЗЂНјаа
ЁОНтЮіЁП
ЃЈ1ЃЉЂйгЩгкИУЗДгІЕФе§ЗДгІЪЧЮќШШЗДгІЃЌЫљвдЮТЖШЩ§ИпЃЌЛЏбЇЦНКте§ЯђвЦЖЏЃЌДяЕНаТЕФЦНКтЪБЦНКтГЃЪ§KжЕдіДѓЃЛЂк1 100 ЁцЪБВтЕУИпТЏжаЃЌc(CO2)=0.025 molЁЄL-1ЃЌc(CO)=0.1 molЁЄL-1ЃЌдђХЈЖШьиQ= c(CO2)ЁТc(CO)=0.025 molЁЄL-1ЁТ0.1 molЁЄL-1=0.25<0.263=KЃЌЫљвддкетжжЧщПіЯТЃЌИУЗДгІЯђе§ЗДгІЗНЯђвЦЖЏЃЛЙЪД№АИЮЊЃКдіДѓЃЛгвЃЛ
ЃЈ2ЃЉЂйИљОнЭМЯёПЩжЊЃКДгЗДгІПЊЪМЕНКтЃЌV(CO2)=0.75mol/LЁТ10min=0.075mol/(LЁЄmin)ЃЌV(H2)=3V(CO2)= 0.225mol/(LЁЄmin)ЃЛCO2ЕФзЊЛЏТЪЮЊ![]() ЁС100%ЃН75%ЃЛЦНКтЪБЧтЦјЁЂЖўбѕЛЏЬМЁЂМзДМКЭЫЎеєЦјЕФЮяжЪЕФСПХЈЖШЗжБ№ЪЧ0.75mol/LЁЂ0.25mol/LЁЂ0.75mol/LЁЂ0.75mol/LЃЌЫљвдИУЮТЖШЯТЩЯЪіЗДгІЕФЦНКтГЃЪ§KЃН
ЁС100%ЃН75%ЃЛЦНКтЪБЧтЦјЁЂЖўбѕЛЏЬМЁЂМзДМКЭЫЎеєЦјЕФЮяжЪЕФСПХЈЖШЗжБ№ЪЧ0.75mol/LЁЂ0.25mol/LЁЂ0.75mol/LЁЂ0.75mol/LЃЌЫљвдИУЮТЖШЯТЩЯЪіЗДгІЕФЦНКтГЃЪ§KЃН![]() ЃЛЙЪД№АИЮЊЃК0.225 molЁЄЃЈLЁЄminЃЉ-1ЃЛЃЛ75%ЃЛ
ЃЛЙЪД№АИЮЊЃК0.225 molЁЄЃЈLЁЄminЃЉ-1ЃЛЃЛ75%ЃЛ![]() L2/mol2ЃЛ
L2/mol2ЃЛ
ЂкaЃЎЩ§ИпЮТЖШЃЌЦНКтФцЯђвЦЖЏЃЌ![]() МѕаЁЃЌaДэЮѓЃЛbЃЎдйГфШыH2ЪЙЦНКте§ЯђвЦЖЏЃЌ
МѕаЁЃЌaДэЮѓЃЛbЃЎдйГфШыH2ЪЙЦНКте§ЯђвЦЖЏЃЌ ![]() діДѓЃЌbе§ШЗЃЛcЃЎдйГфШыCO2 ЦНКте§ЯђвЦЖЏЃЌЕЋЪЧІЄc(CO2) ДѓгкІЄc(CH3OH)ЃЌ БШжЕМѕаЁЃЌcДэЮѓЃЛdЃЎНЋH2OЃЈgЃЉДгЬхЯЕжаЗжРыЃЌЦНКте§ЯђвЦЖЏЃЌБШжЕдіДѓЃЌdе§ШЗЃЛEЃЎГфШыHeЃЈgЃЉЃЌЦНКтВЛвЦЖЏЃЌБШжЕВЛИФБфЃЌeДэЮѓЃЌД№АИбЁbdЁЃ
діДѓЃЌbе§ШЗЃЛcЃЎдйГфШыCO2 ЦНКте§ЯђвЦЖЏЃЌЕЋЪЧІЄc(CO2) ДѓгкІЄc(CH3OH)ЃЌ БШжЕМѕаЁЃЌcДэЮѓЃЛdЃЎНЋH2OЃЈgЃЉДгЬхЯЕжаЗжРыЃЌЦНКте§ЯђвЦЖЏЃЌБШжЕдіДѓЃЌdе§ШЗЃЛEЃЎГфШыHeЃЈgЃЉЃЌЦНКтВЛвЦЖЏЃЌБШжЕВЛИФБфЃЌeДэЮѓЃЌД№АИбЁbdЁЃ
ЂлгЩгкИУЗДгІЕФЁїHЃО0ЃЌЁїSЃМOЃЌЁїH-TЁїSЃО0ЃЌЫљвдВЛФмздЗЂНјааЁЃЙЪД№АИЮЊЃКВЛФмЃЌвђЮЊИУЗДгІЕФЁїHЃО0ЃЌЁїS<O ЁїH-TЁїSЃО0ЃЌВЛФмздЗЂНјааЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋAlЬѕВхШы6 molЁЄL-1бЮЫсжаЃЌЗДгІЙ§ГЬжаВњЩњH2ЫйТЪБфЛЏЧщПіШчЭМ1ЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
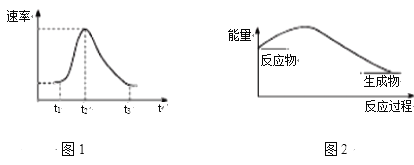
A. ЭМ1жаПЊЪМНзЖЮВњЩњЦјЬхЫйТЪНЯТ§ПЩФмЪЧвђЮЊAlЬѕБэУцгабѕЛЏФЄ
B. ЭМ1жагАЯьt1ЁЋt2ЖЮЫйТЪБфЛЏЕФжївЊдвђЪЧЗДгІЗХШШЕМжТШмвКЮТЖШЩ§Ип
C. ЭМ1жагАЯьt2ЁЋt3ЫйТЪБфЛЏЕФжївЊвђЫиЪЧc(Cl-)
D. ЭМ2ПЩвдБэЪОИУЗДгІЙ§ГЬЕФФмСПБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЫФИіВЛЭЌШнЦїжаЃЌВЛЭЌЬѕМўЯТНјааЗДгІN2+3H22NH3ЃЌИљОндкЯрЭЌЪБМфФкВтЖЈЕФНсЙћЃЌХаЖЯИУЗДгІЕФЫйТЪзюДѓЕФЪЧЃЈ ЃЉ
A. ІдЃЈNH3ЃЉ=0.5molLЉ1minЉ1
B. ІдЃЈH2ЃЉ=0.3molLЉ1minЉ1
C. ІдЃЈN2ЃЉ=0.2molLЉ1minЉ1
D. ІдЃЈH2ЃЉ=0.01molLЉ1sЉ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЯТЃЌ ЗДгІH2(g)+CO2(g)![]() H2O(g)+CO(g)ЕФЦНКтГЃЪ§
H2O(g)+CO(g)ЕФЦНКтГЃЪ§![]() ЁЃИУЮТЖШЯТдкЬхЛ§ОљЮЊ10 LЕФШ§ИіУмБеШнЦїжаЗжБ№МгШыЗДгІЮяЃЌЦ№ЪММгШыСПШчЭМЫљЪОЃКЯТСаХаЖЯВЛе§ШЗЕФЪЧ
ЁЃИУЮТЖШЯТдкЬхЛ§ОљЮЊ10 LЕФШ§ИіУмБеШнЦїжаЗжБ№МгШыЗДгІЮяЃЌЦ№ЪММгШыСПШчЭМЫљЪОЃКЯТСаХаЖЯВЛе§ШЗЕФЪЧ
Ц№ЪМСП | Мз | вв | Бћ |
H2 ЃЈmolЃЉ | 1 | 2 | 2 |
CO2ЃЈmolЃЉ | 1 | 1 | 2 |
A.ЗДгІПЊЪМЪБЃЌМзжаЕФЗДгІЫйТЪзюТ§ЃЌБћжаЕФЗДгІЫйТЪзюПь
B.ЦНКтЪБЃЌМзКЭБћжаCO2ЕФзЊЛЏТЪЯрЕШЃЌОљЪЧ60ЃЅ
C.ЦНКтЪБ,ввжаЃШ2ЕФзЊЛЏТЪДѓгк60%
D.ЦНКтЪБЃЌБћжаЃу(ЃШ2 ) ЪЧ0. 08 molЁЄL-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђвЛЖЈХЈЖШЕФBa(OH)2ШмвКжаЕЮШыФГХЈЖШЕФNH4HSO4ШмвКЃЌЦфЕМЕчФмСІЫцЕЮШыШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
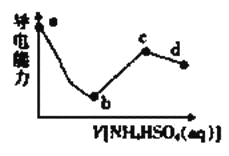
A.bЕуШмвКжажЛДцдкH2OЕФЕчРыЦНКтКЭBaSO4ЕФГСЕэШмНтЦНКт
B.cЕуЙівКжаЃКc(H+)+c(NH4+)=c(NH3H2O)+c(OH-)
C.abЖЮЗДгІЕФРызгЗНГЬЪНЮЊ![]()
D.bcЖЮжЎМфДцдкФГЕуЃЌЦфШмвКжаЃКc(NH4+)=2c(SO42-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЕчНтжЪШмвКЕФЫЕЗЈВЛе§ШЗЕФЪЧ
A. Яђ![]() ШмвКжаЭЈШы
ШмвКжаЭЈШы![]() ЃЌ
ЃЌ![]() МѕаЁ
МѕаЁ
B. НЋ![]() ЕФ
ЕФ![]() ШмвКДг
ШмвКДг![]() Щ§ЮТжС
Щ§ЮТжС![]() ЃЌ
ЃЌ![]() діДѓ
діДѓ
C. Яђ![]() ЕФHFШмвКжаЕЮМгNaOHШмвКжСжаадЃЌ
ЕФHFШмвКжаЕЮМгNaOHШмвКжСжаадЃЌ![]() =1
=1
D. Яђ![]() ЕФ
ЕФ![]() ШмвКжаМгШыЩйСПЫЎЃЌ
ШмвКжаМгШыЩйСПЫЎЃЌ![]() діДѓ
діДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
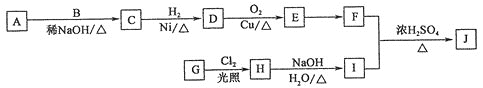
ЁОЬтФПЁПРБНЗЫиѕЅОпгаДйНјЬхФкжЌЗОбѕЛЏЕФЙІФмЃЌПЩгУгкжЮСЦЗЪХжжЂЃЌКЯГЩФГРБНЗЫиѕЅJ(![]() )ЕФСїГЬШчЭМЫљЪОЁЃAЁЂBЁЂEжаЕФКЌбѕЙйФмЭХжжРрЯрЭЌЃЌAКЭBКЫДХЙВеёЧтЦзОљга2ИіЗхЃЌAЯрЖдЗжзгжЪСПБШBЕФДѓЁЃ
)ЕФСїГЬШчЭМЫљЪОЁЃAЁЂBЁЂEжаЕФКЌбѕЙйФмЭХжжРрЯрЭЌЃЌAКЭBКЫДХЙВеёЧтЦзОљга2ИіЗхЃЌAЯрЖдЗжзгжЪСПБШBЕФДѓЁЃ
вбжЊЃК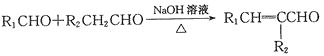
ЂХJжаЙйФмЭХГ§єЧЛљЭтЛЙга________ЃЌGЁњHЕФЗДгІРраЭЮЊ________ЁЃ
ЂЦDЕФНсЙЙМђЪНЮЊ______________ЃЌAЕФУћГЦЪЧ________________ЁЃ
ЂЧаДГіHЁњIЕФЛЏбЇЗДгІЗНГЬЪНЃК_______________________________________________ЁЃ
ЂШEгаЖржжЭЌЗжвьЙЙЬхЃЌЦфжаТњзуЯТСаЬѕМўЕФга________жжЃЌаДГіКЫДХЙВеёЧтЦзга3ИіЗхЕФЮяжЪЕФНсЙЙМђЪНЃК__________________ЁЃ
ЂйЗжзгжаКЌгаСНИіМзЛљЂкКЌгаЬМбѕЫЋМќ
ЂЩвдввШЉЮЊЛљБОдСЯЃЌОШ§ВНЗДгІжЦБИ![]() ТШЖЁЫсЃЌЗТееЩЯЪіБэДяЗНЪНЃЌаДГіЯргІЕФСїГЬЭМЃК____________________________________ЁЃ
ТШЖЁЫсЃЌЗТееЩЯЪіБэДяЗНЪНЃЌаДГіЯргІЕФСїГЬЭМЃК____________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПFeCl3(aq)гыKSCN(aq)ЛьКЯЪБДцдкЯТСаЦНКтЃКFe3+(aq)ЃЋSCN-(aq)![]() Fe(SCN)2+(aq)ЁЃвбжЊЦНКтЪБЃЌЮяжЪЕФСПХЈЖШc[Fe(SCN)2+]гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
Fe(SCN)2+(aq)ЁЃвбжЊЦНКтЪБЃЌЮяжЪЕФСПХЈЖШc[Fe(SCN)2+]гыЮТЖШTЕФЙиЯЕШчЭМЫљЪОЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
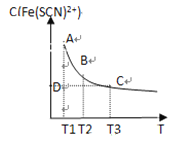
A. FeCl3(aq)гыKSCN(aq)ЗДгІЕФШШЛЏбЇЗДгІЗНГЬЪНЮЊFe3ЃЋ(aq)ЃЋSCNЁЊ(aq)![]() Fe(SCN)2ЃЋ(aq) ІЄH ЃО0
Fe(SCN)2ЃЋ(aq) ІЄH ЃО0
B. ЮТЖШЮЊT1ЁЂT2ЪБЃЌЗДгІЕФЦНКтГЃЪ§ЗжБ№ЮЊK1ЁЂK2ЃЌдђK1ЃМK2
C. ЗДгІДІгкDЕуЪБЃЌвЛЖЈгаІде§ЃОІдФц
D. AЕугыBЕуЯрБШЃЌAЕуЕФc(Fe3ЃЋ)Дѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЦћГЕЮВЦјжаКЌгаCOЁЂNOЕШгаКІЦјЬхЁЃ
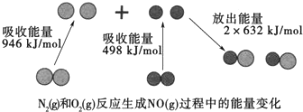
ЃЈ1ЃЉЦћГЕЮВЦјжаNOЩњГЩЙ§ГЬЕФФмСПБфЛЏШчЭМЪОЁЃ1molN2КЭ1molO2ЭъШЋЗДгІЩњГЩNOЛс____ЃЈЬюЁАЮќЪеЁБЛђЁАЗХГіЁБЃЉ____kJФмСПЁЃ
ЃЈ2ЃЉЭЈЙ§NOДЋИаЦїПЩМрВтЦћГЕЮВЦјжаNOЕФКЌСПЃЌЦфЙЄзїдРэШчЭМЫљЪОЃКЃЈЬсЪОЃКO2-ПЩдкДЫЙЬЬхЕчНтжЪжаздгЩвЦЖЏЃЉ
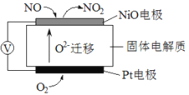
ЂйNiOЕчМЋЩЯЗЂЩњЕФЪЧ___________ЗДгІЃЈЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБЃЉЁЃ
ЂкЭтЕчТЗжаЃЌЕчзгЪЧДг_________ЕчМЋСїГіЃЈЬюЁАNiOЁБЛђЁАPtЁБЃЉЃЎ
ЂлPtЕчМЋЩЯЕФЕчМЋЗДгІЪНЮЊ________________________ЁЃ
ЃЈ3ЃЉвЛжжаТаЭДпЛЏМСгУгкNOКЭCOЕФЗДгІЃК2NO+2CO![]() 2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
2CO2+N2ЁЃвбжЊдіДѓДпЛЏМСЕФБШБэУцЛ§ПЩЬсИпИУЗДгІЫйТЪЃЌЮЊСЫбщжЄЮТЖШЁЂДпЛЏМСЕФБШБэУцЛ§ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЙцТЩЃЌФГЭЌбЇЩшМЦСЫШ§зщЪЕбщЃЌВПЗжЬѕМўвбОЬюдкЯТБэжаЁЃ
ЪЕбщБрКХ | tЃЈЁцЃЉ | NOГѕЪМХЈЖШ ЃЈmol/LЃЉ | COГѕЪМХЈЖШЃЈmol/LЃЉ | ДпЛЏМСЕФБШБэУцЛ§ЃЈm2/gЃЉ |
Ђё | 280 | 1.2ЁС10Љ3 | 5.80ЁС10Љ3 | 82 |
Ђђ | 280 | 1.2ЁС10Љ3 | b | 124 |
Ђѓ | 350 | a | 5.80ЁС10Љ3 | 82 |
ЂйЧыНЋБэжаЪ§ОнВЙГфЭъећЃКa ___________ЁЃ
ЂкФмбщжЄЮТЖШЖдЛЏбЇЗДгІЫйТЪЙцТЩЕФЪЧЪЕбщ____________ЃЈЬюЪЕбщађКХЃЉЁЃ
ЂлЪЕбщЂёКЭЪЕбщЂђжаЃЌNOЕФЮяжЪЕФСПХЈЖШcЃЈNOЃЉЫцЪБМфtЕФБфЛЏЧњЯпШчЭМЫљЪОЃЌЦфжаБэЪОЪЕбщЂђЕФЪЧЧњЯп_______ЃЈЬюЁАМзЁБЛђЁАввЁБЃЉЁЃ
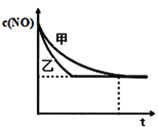
ЃЈ4ЃЉдкШнЛ§ЙЬЖЈЕФОјШШШнЦїжаЗЂЩњЗДгІ2NO+2CO![]() 2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
2CO2+N2ЃЌВЛФмЫЕУївбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈВЛЖЈЯюбЁдёЃЉЃЛ
AЃЎШнЦїФкЛьКЯЦјЬхЮТЖШВЛдйБфЛЏ BЃЎШнЦїФкЕФЦјЬхбЙЧПБЃГжВЛБф
CЃЎ2ІдФц(NO)=Іде§(N2) DЃЎШнЦїФкЛьКЯЦјЬхУмЖШБЃГжВЛБф
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com