
����Ŀ��ij�¶��£� ��ӦH2(g)+CO2(g)![]() H2O(g)+CO(g)��ƽ�ⳣ��
H2O(g)+CO(g)��ƽ�ⳣ��![]() �����¶����������Ϊ10 L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ����
�����¶����������Ϊ10 L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ����
��ʼ�� | �� | �� | �� |
H2 ��mol�� | 1 | 2 | 2 |
CO2��mol�� | 1 | 1 | 2 |
A.��Ӧ��ʼʱ�����еķ�Ӧ�������������еķ�Ӧ�������
B.ƽ��ʱ���ͱ���CO2��ת������ȣ�����60��
C.ƽ��ʱ,���У�2��ת���ʴ���60%
D.ƽ��ʱ�����У�(��2 ) ��0. 08 mol��L-1
���𰸡�C
��������
A����������������ʱ������Ӧ���Ũ�ȣ���Ӧ���ʼӿ죬��С��Ӧ���Ũ�ȣ���Ӧ���ʼ�С�������ڷ�Ӧ��ʼʱ����������Ũ����С����������Ũ�������˼��еķ�Ӧ�������������еķ�Ӧ������죬��ȷ��
B�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ���ס��������ʵ�Ũ�ȱ���ȣ�����ƽ��ʱ���ͱ���CO2��ת������ȣ��������H2��Ӧ�����ʵ�����x����ƽ��ʱ�����ʵ����ʵ����ֱ���:H2:((1-x)��CO2:((1-x)��H2O:x��CO��x��x2/(1-x)2=9/4�����x=0.6������������ʵ�ת���ʾ���60������ȷ��
C�������ң����������������䣬��H2Ũ�����������ƽ���ƶ�ԭ��������Ӧ���Ũ�ȣ�ƽ�������ƶ���ʹ�������ʵ�ת�������������ʵ�ת���ʽ��͡����ƽ��ʱ, ���У�2��ת����С��60%������
D�����ڼס��������ʵ�ת���ʶ���60%������ƽ��ʱ�����У�(��2 ) ��2mol��40%��10L="0." 08 mol��L-1����ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£���10mL0.40mol/LH2O2 ��Һ�м�������FeCl3��Һ(����������������Һ����ı仯),��ͬʱ�̲������O2�����(������Ϊ��״����)�����ʾ��
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
������ʾ,��Ӧ���������У���2Fe3++H2O2��2Fe2++2H++O2����H2O2+2Fe2++2H+��2H2O+2Fe3+����Ӧ�����������仯��ͼ��ʾ������˵����ȷ����

A. Fe2+�������������������ķֽ�����
B. ��Ӧ�١��ھ��Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq)��2H2O(l)+O2(g)�����ȷ�Ӧ
D. 0��6min�ڵ�ƽ����Ӧ����v(H2O2)��3.33��10-2mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���綾���軯�ƣ�NaCN��������ˮ�������ɾ綾��ȼ��HCN���壬ͬʱHCN������ˮ���ܣ����ˮ��Ⱦ����֪��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ�� (25��C) | Ka=l. 77��10-4 | Ka=5.0��10-10 | Ka1=4.3��10-7 Ka2=5. 6��10-11 |
����ѡ��������
A.��NaCN��Һ��ͨ��������CO2���������ӷ�ӦΪ��2CN-+H2O+CO2= 2HCN+CO32��
B.�����£�������CN-��ˮʱ������NaOH��Һ����pH��9����ʱc(CN-)��c(HCN)
C.�к͵��������pH��HCOOH��Һ��HCN��Һ����NaOH�����ʵ���ǰ��С�ں���
D.������������ʵ���Ũ�ȵ�HCOONa��NaCN��Һ��������������ǰ�ߴ��ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��![]() �ں��º����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
�ں��º����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��
![]() ��λʱ��������n
��λʱ��������n![]() ��ͬʱ����2n
��ͬʱ����2n![]() ��
��
![]() ��λʱ��������n
��λʱ��������n![]() ��ͬʱ����2nmolNO��
��ͬʱ����2nmolNO��
![]() ����������ɫ���ٸı��״̬��
����������ɫ���ٸı��״̬��
![]() ���������
���������![]() ���䣻
���䣻
![]() ������������NO������������ȣ�
������������NO������������ȣ�
![]() ������ѹǿ����ʱ��仯���仯��
������ѹǿ����ʱ��仯���仯��
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶Ⱥ�ѹǿ�£��Է�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
| CO2 | H2 | CO | H2O |
�� | amol | amol | 0mol | 0mol |
�� | 2amol | amol | 0mol | 0mol |
�� | 0mol | 0mol | amol | amol |
�� | amol | 0mol | amol | amol |
������������ﵽƽ���n(CO)�Ĵ�С˳����
A. �ң�����������B. �ң������ף���
C. �����ң�������D. ���������ң���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���0.1molAgCl�������1L0.1molL-1Na2CO3��Һ�У���ֽ���(������Һ������仯)����֪��Ksp(AgCl)=2��10-10��Ksp(Ag2CO3)=1��10-11�������й�˵����ȷ����( )
A.����ת����Ӧ![]() ��ƽ�ⳣ��Ϊ20molL-1
��ƽ�ⳣ��Ϊ20molL-1
B.Լ��10-5molAgCl�ܽ�
C.��Ӧ����Һ�еģ�c(Na+)>c(CO32-)>c(Cl-)>c(Ag+)>c(H+)
D.��Ӧ����Һ�еģ�c(Na+)+c(Ag+)=2c(CO32-)+c(HCO3-)+c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼ѭ������������ĸ߶����ӣ���֪ú������ȿ�����ˮ������Ӧ������CO��H2Ϊ���ĺϳ������ϳ����й㷺Ӧ�ã��Իش��������⣺
(1)��¯������CO�������Ҫ��;֮һ���������ӦΪ��FeO(s)+CO(g)![]() Fe(s)+CO2(g) ��H��0����֪��1100��Cʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
Fe(s)+CO2(g) ��H��0����֪��1100��Cʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.263��
���¶����ߣ�ƽ���ƶ���ﵽ��ƽ�⣬��ʱƽ�ⳣ��ֵ____(��������������С����������)��
��1100��Cʱ��ø�¯�У�c(CO2)=0.025mol��L��1��c(CO)=0.1mol��L��1��������������£��÷�Ӧ��һʱ����_______����(����������������)��
(2)Ŀǰ��ҵ��Ҳ����CO2������ȼ�ϼ״�CH3OH���йط�ӦΪ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H=��49.0KJmol��1��ij�¶��£������Ϊ1L�����ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g)����H=��49.0KJmol��1��ij�¶��£������Ϊ1L�����ܱ������У�����1molCO2��3molH2����Ӧ�����в��CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
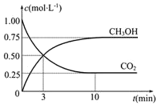
�ٷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=______��CO2��ת����Ϊ_____�����¶���������Ӧ��ƽ�ⳣ��K=_____(������ʾ)��
�ڷ�Ӧ�ﵽƽ���������ʹ![]() ��ֵ����Ĵ�ʩ��______(�����)��
��ֵ����Ĵ�ʩ��______(�����)��
a�������¶� b���ٳ���H2 c���ٳ���CO2 d����H2O(g)����ϵ�з��� e������He(g)
�����������������Ʒ�Ӧ2CO(g)=2C(s)+O2(g) (��H��0)������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�����2L�ܱ������м���һ����A���������»�ѧ��Ӧ��
2A(g)![]() B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����
B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����
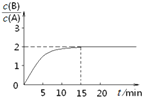
A.���¶��´˷�Ӧ��ƽ�ⳣ��Ϊ3.2
B.A�ij�ʼ���ʵ���Ϊ4 mol
C.��Ӧ����ƽ��ʱ���ų���������193kJ
D.��Ӧ��ƽ��ʱ��A��ת����Ϊ80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
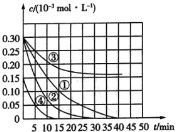
ʵ���� | �¶ȣ�K�� | pH |
�� | 298 | 1 |
�� | 310 | 1 |
�� | 298 | 7 |
�� | 298 | 1 |
A.ʵ�����15min��M�Ľ�������Ϊ![]()
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.������������ͬ��ʵ��٢�˵��M��Ũ��ԽС�����������Խ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com