
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
科目:高中化学 来源: 题型:
【题目】欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CO2气体中混有的SO2气体,下列有关仪器和药品的组合中,合理的是
①洗气瓶 ②干燥管 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液
A. ①⑤ B. ②⑤ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药上用作祛痰剂和利尿剂,也用于治疗甲状腺肿病,生活中用作照相胶片感光剂,碘的助溶剂,也用于配制碘乳剂。某实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
回答下列问题:
(1)水合肼的制备原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置组装制备水合肼,连接顺序为_____→ → → → → (用字母表示).
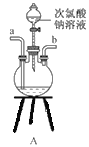
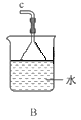
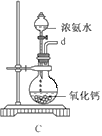
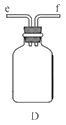
②装置C中发生反应的化学方程式为________________,装置D的作用是_______________。
(2)碘化钠的制备步骤
向三颈烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60-70℃至反应充分;继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;将分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①反应温度不宜超过70℃的原因是___________________ ,该步骤反应完全的现象是______________。
②IO-被还原的离子方程式为_______________________________。
③“将溶液与活性炭分离”的方法是____________。
④该实验小组产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________周期、_________族;G的元素符号是_________。
(2)B的原子结构示意图是_________;C与D组成的既含离子键又含共价键的化合物电子式是_________。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:

X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________,Y溶液与过量W反应的离子方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的说法中,正确的是( )
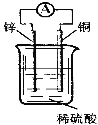
A. 铜片上发生氧化反应
B. 电子由铜片通过导线流向锌片
C. 该装置能将化学能转化为电能
D. 锌片是该装置的正极,该电极反应为Zn+2e—==Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称:__________;装置C中三颈瓶置于冰水浴中的目的是_____________。
(2)装置B吸收的气体是__________,装置D的作用是___________________________。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为________________________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③________________________________________________________。(补充完整)
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+![]() Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为____________。
Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内的试剂和方法除去下列各物质中的少量杂质,不正确的是( )
A.苯中含有苯酚(浓溴水,过滤)
B.乙醇中的乙酸(CaO固体、蒸馏)
C.乙酸乙酯中含有乙酸(饱和Na2CO3溶液、分液)
D.乙烷中含有乙烯(溴水、洗气)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com