
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与![]() 的变化关系
的变化关系
C. 当溶液中c(X2—)=c(HX—)时,溶液为碱性
D. 当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
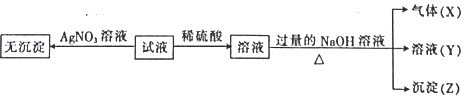
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
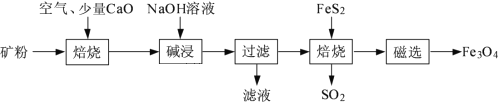
(1)流程中将高硫铝土矿磨成矿粉的目的是_________________________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
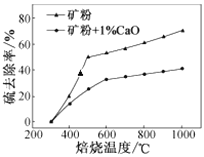
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1—![]() )×100%。
)×100%。
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________。
(3)由“过滤”得到的滤液生产氧化铝的反应过程中涉及的离子方程式是______________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A,在一定条件下发生反应:xA(g)![]() yB(g)+pC(g)+qD(g)。已知:平均反应速率
yB(g)+pC(g)+qD(g)。已知:平均反应速率![]() ;反应至2min时,A的物质的量减少为起始时的
;反应至2min时,A的物质的量减少为起始时的![]() ,生成B、D的物质的量分別为
,生成B、D的物质的量分別为![]() a mol、a mol。回答下列问题:
a mol、a mol。回答下列问题:
(1)0~2min内,![]() __________________。
__________________。
(2)该反应的化学方程式为_________________________________________。
(3)反应xA(g)![]() yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
①A(g)的消耗速率与C(g)的生成速率之比为x:p
②A(g)的物质的量保持恒定
③A(g)的消耗速率与D(g)的消耗速率之比为q:x
④B(g)和C(g)的物质的量之比为y:p
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则m、n应满足的关系为__________(用含m、n的等式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )

A. 反应开始到10 s,用Z表示反应速率为0.158 mol·L-1·s-1
B. 反应开始到10 s时,Y的转化率为79.0%
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有棕色、黑色现象出现。过一段时间后,发现经硫酸酸化的高锰酸钾溶液褪色。

甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____(填“甲”或“乙”),理由是_____ (填代号)。
A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应
C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物
D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性
(2)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠? _____(填“可靠”或“不可靠”);理由是_____________________。若你认为不可靠,改进上述实验方案,证明乙烯中是否含有SO2:__________________ 。
(3)丁同学对上述实验方案进行了适当改进,用于证明乙烯能否发生加成反应,他的改进方法可能是在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量_____的洗气瓶且将(Ⅱ)瓶中溶液换成_____,发生反应的化学方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com