
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
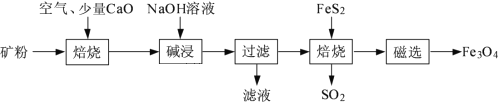
(1)流程中将高硫铝土矿磨成矿粉的目的是_________________________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
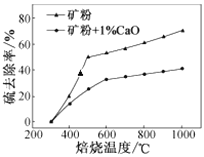
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1—![]() )×100%。
)×100%。
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________。
(3)由“过滤”得到的滤液生产氧化铝的反应过程中涉及的离子方程式是______________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________。
【答案】增大反应的接触面积,加快化学反应速率 FeS2 硫元素转化为CaSO4而留在矿粉中 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、2Al(OH)3![]() Al2O3+3H2O 1∶16
Al2O3+3H2O 1∶16
【解析】
(1)磨成矿粉,可以增大反应的接触面积,加快化学反应速率;
(2)根据流程图并结合焙烧温度随硫去除率的图像进行分析;
(3)滤液中含有AlO2-,即由AlO2-生产氧化铝;
(4)利用得失电子守恒进行计算;
(1)将高硫铝土矿磨成矿粉,可以增大反应的接触面积,加快化学反应速率;
(2)①由于多数硫酸盐的分解温度高于600度,FeS2在低于500℃焙烧时,能与空气中的氧气反应生成氧化铁和二氧化硫,故不添加氧化钙的矿粉在焙烧时,去除的硫元素主要来源于FeS2;②700℃,焙烧时添加氧化钙后,硫元素转化为硫酸钙而留在矿粉中,使硫矿粉硫去除率降低 ;
(3)滤液中含有AlO2-,用滤液生产氧化铝的反应过程中涉及的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(4)分析反应前后元素化合价的变化,利用得失电子守恒知:2/3 n(FeS2)+5×2n(FeS2)=1/3 ×2n(Fe2O3)。解得n(FeS2)∶n(Fe2O3)=1:16;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:
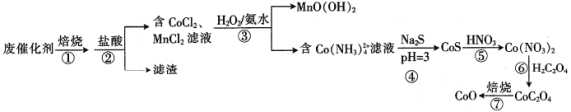
回答下列问题:
(1)步骤①焙烧的目的是_________________________________。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________(填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CO2气体中混有的SO2气体,下列有关仪器和药品的组合中,合理的是
①洗气瓶 ②干燥管 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液
A. ①⑤ B. ②⑤ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
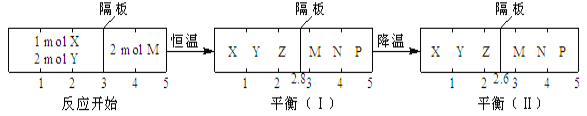
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医药上用作祛痰剂和利尿剂,也用于治疗甲状腺肿病,生活中用作照相胶片感光剂,碘的助溶剂,也用于配制碘乳剂。某实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
回答下列问题:
(1)水合肼的制备原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置组装制备水合肼,连接顺序为_____→ → → → → (用字母表示).
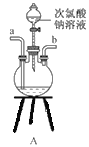
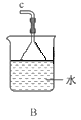
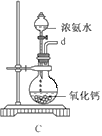
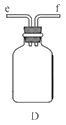
②装置C中发生反应的化学方程式为________________,装置D的作用是_______________。
(2)碘化钠的制备步骤
向三颈烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60-70℃至反应充分;继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;将分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①反应温度不宜超过70℃的原因是___________________ ,该步骤反应完全的现象是______________。
②IO-被还原的离子方程式为_______________________________。
③“将溶液与活性炭分离”的方法是____________。
④该实验小组产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() 。下列有关说法错误的是
。下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物分子中所有碳原子可能共平面
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的说法中,正确的是( )
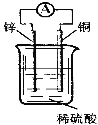
A. 铜片上发生氧化反应
B. 电子由铜片通过导线流向锌片
C. 该装置能将化学能转化为电能
D. 锌片是该装置的正极,该电极反应为Zn+2e—==Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com