
【题目】短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是_________周期、_________族;G的元素符号是_________。
(2)B的原子结构示意图是_________;C与D组成的既含离子键又含共价键的化合物电子式是_________。
(3)E单质能与D的最高价氧化物的水化物浓溶液反应放出氢气,反应的化学方程式是__________________;由上述六种元素中的三种组成的某种盐,水溶液显碱性,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式是__________________。
(4)由A、B、C、E中的某些元素组成的化合物X、Y、Z、W有如下转化关系:

X、Y、Z、W中均由三种元素组成,Z是一种强酸,则Z的化学式是___________,Y溶液与过量W反应的离子方程式是___________________________________。
【答案】二 第ⅥA Cl 
![]() 2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ClO- + 2I- +2H+ = Cl- + I2 + 2H2O HNO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ClO- + 2I- +2H+ = Cl- + I2 + 2H2O HNO3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
根据题目信息科推出:A的原子半径最小(稀有气体元素除外),A是H;C的最外层电子数是次外层的3倍,C是O;B与C相邻,B是N;E是地壳中含量最多的金属元素,E是Al;C、D的最外层电子数之和与G的最外层电子数相等,D是Na;G是Cl。
(1)C是O,在元素周期表中的位置是第二周期,第ⅥA族;G的元素符号是Cl;故答案为:二;第ⅥA;Cl;
(2)B是N,原子结构示意图是 ;C与D组成的既含离子键又含共价键的化合物是Na2O2,电子式是:
;C与D组成的既含离子键又含共价键的化合物是Na2O2,电子式是:![]() ;故答案为:
;故答案为: ;
;![]() ;
;
(3)铝与氢氧化钠溶液反应的化学方程式为:2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑;由上述六种元素中的三种组成的盐是NaClO,将它滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,说明有碘单质生成,离子方程式是ClO- + 2I- +2H+ = Cl- + I2 + 2H2O;故答案为:2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑;ClO- + 2I- +2H+ = Cl- + I2 + 2H2O;
(4)A、B、C、E分别是H、N、O、Al,Z是一种强酸,则Z是HNO3;由于X、Y、Z、W中均由三种元素组成,X是Al(OH)3,Y是Al(NO3)3、Z是HNO3、W是NH3·H2O, Y溶液与过量W反应的离子方程式是: Al3++3NH3·H2O=Al(OH)3↓+3NH4+;故答案为:HNO3; Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】空气中的CO、NO、NO2、SO2都能使人中毒,其中易与人体中的血红蛋白结合,使血红蛋白失去运载O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有A、B、X、Y、Z五种短周期元素,原子序数依次增大。它们的性质或原子结构如下表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含量最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素 |
Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
①X元素在元素周期表中的位置是______________;
②Z单质通入Y的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为___________________________________________________;
③化合物甲由A和B两种元素组成且质量比为3:14,甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置关系如图所示
X | ||
Y | ||
Z |
①X元素单质的化学式是_________,若X核内中子数与质子数相等,则X单质的摩尔质量为________;
②Y单质的电子式是_________;Z与钙形成的化合物的电子式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

(1)装置甲中发生反应的化学方程式为________________________。
(2)装置丙中的试管内发生反应的离子方程式为:_______________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加NH4SCN溶液,用离子方程式表示检验原理___________。
(5)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
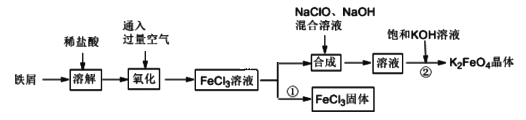
请回答下列问题:
(Ⅰ)(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为_______________________________。
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
(4)过程①制取FeCl3固体的具体操作步骤是_______________________。若使6.5 mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH 小于_________{已知该实验条件下,Ksp[(Fe(OH)3]=6.5×10-36,Kw=1.0×10-13(水离子积)}
(Ⅱ)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
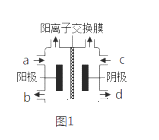
(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电解池总反应(化学方程式)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是

A. 电池工作时,石墨电极Ⅰ上电极反应式为2NO2 2e +O2![]() N2O5
N2O5
B. 电池工作时,![]() 向石墨电极Ⅰ移动
向石墨电极Ⅰ移动
C. 该电池充电时,石墨电极Ⅱ连接电源的负极
D. 电池工作时,外电路中流过1 mol电子,则消耗46 g NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com