
����Ŀ��(1)����A��B��X��Y��Z���ֶ�����Ԫ�أ�ԭ�����������������ǵ����ʻ�ԭ�ӽṹ���±���
Ԫ�� | ���ʻ�ԭ�ӽṹ |
A | ԭ�Ӻ���ֻ��һ������ |
B | �����ǿ����к����������� |
X | ԭ�ӵ������������Ǵ�����������3�� |
Y | ������Ԫ����ԭ�Ӱ뾶����Ԫ�� |
Z | ��������ϼ���������ϼ۵Ĵ�����Ϊ6 |
��ش�
��XԪ����Ԫ�����ڱ��е�λ����______________��
��Z����ͨ��Y������������Ӧˮ�������Һ�У����Եõ�Ư��Һ,��Ӧ��Ӧ�����ӷ���ʽΪ___________________________________________________��
�ۻ��������A��B����Ԫ�������������Ϊ3:14������X�����ڴ��������������·����ķ�Ӧ�ǹ�ҵ����ȡ����Ļ�����д���÷�Ӧ�Ļ�ѧ����ʽ____________��
(2)������Ԫ��X��Y��Z�����ڱ��е�λ�ù�ϵ��ͼ��ʾ
X | ||
Y | ||
Z |
��XԪ�ص��ʵĻ�ѧʽ��_________����X��������������������ȣ���X���ʵ�Ħ������Ϊ________��
��Y���ʵĵ���ʽ��_________��Z����γɵĻ�����ĵ���ʽ��__________��
���𰸡��ڶ����ڵڢ�A�� Cl2+2OH����Cl��+ClO��+H2O 4NH3+5O2![]() 4NO+6H2O He 4 g/mol
4NO+6H2O He 4 g/mol ![]()
![]()
��������
��1��Aԭ�Ӻ���ֻ��һ�����ӣ�A��H��B�����ǿ����к����������壬B��N��Xԭ�ӵ������������Ǵ�����������3����X��O��Y�Ƕ�����Ԫ����ԭ�Ӱ뾶����Ԫ�أ�Y��Na��Z����������ϼ���������ϼ۵Ĵ�����Ϊ6����Z��Cl��
��2�����ݶ�����Ԫ��X��Y��Z�����ڱ��е�λ�ù�ϵ��֪X��He��Y��F��Z��S���ݴ˽��
��1����XԪ����O����Ԫ�����ڱ��е�λ���ǵڶ����ڵڢ�A�壻
��Z���ʼ�����ͨ��Y������������Ӧˮ�������Һ���������У����Եõ�Ư��Һ����Ӧ��Ӧ�����ӷ���ʽΪCl2+2OH����Cl��+ClO��+H2O��
�ۻ��������H��N����Ԫ�������������Ϊ3:14����ԭ�Ӹ���֮����3:1�������ǰ���������������Ӧ�Ļ�ѧ����ʽΪ4NH3+5O2![]() 4NO+6H2O��
4NO+6H2O��
��2����XԪ����He�����ʵĻ�ѧʽ��He����X��������������������ȣ�He����������2�����X���ʵ�Ħ������Ϊ4 g/mol��
��Y������F2������ʽ��![]() ��S����γɵĻ����������ӻ�����CaS������ʽ��
��S����γɵĻ����������ӻ�����CaS������ʽ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ڵȵ�������ǣ� ��
A.N2�� COB.CO2��N2O
C.PH3��NH3D.CO2��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʹ��ɵ������У�ͬʱ���ڼ��Լ����Ǽ��Լ���������� �� ��
A.CO2B.H2O2C.H2OD.C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������Դ������·���ˮ�ⷴӦ�� �������ֲ�ͬ���л�� ���������л������Է���������ȣ� ���л��������
A.����B.��ѿ��C.��������D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯����ҽҩ��������̵�����������Ҳ�������Ƽ�״���ײ����������������ེƬ�й����������ܼ���Ҳ�������Ƶ������ijʵ��С����NaOH�����ʵ��ˮ����(N2H4��H2O)Ϊԭ���Ʊ��⻯�ơ�
�ش��������⣺
��1��ˮ���µ��Ʊ�ԭ��Ϊ��NaClO+2NH3=N2H4��H2O+NaCl��
������ͼװ����װ�Ʊ�ˮ���£�����˳��Ϊ_____�� �� �� �� �� (����ĸ��ʾ).
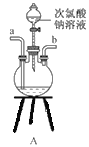
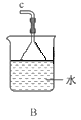
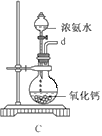
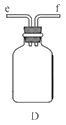
��װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ________________��װ��D��������_______________��
��2���⻯�Ƶ��Ʊ�����
��������ƿ�м���8.2gNaOH��30mLˮ��������ȴ������25.4g���ʵ⣬��������������������60-70������Ӧ���;���������Թ�����N2H4��H2O(ˮ����)����ԭNaIO��NaIO3����NaI��Һ��Ʒ��ͬʱ�ͷ�һ�ֿ����е�ij���壻��������ӦҺ�м���1.0g����̿����а�Сʱ��Ȼ����Һ�����̿����;�����������Һ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ò�Ʒ24.3g��
�ٷ�Ӧ�¶Ȳ��˳���70���ԭ����___________________ ���ò��跴Ӧ��ȫ��������______________��
��IO-����ԭ�����ӷ���ʽΪ_______________________________��
�ۡ�����Һ�����̿���롱�ķ�����____________��
�ܸ�ʵ��С�����Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ���������Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ������˵����ȷ����

A. Z��N����Ԫ�ص����Ӱ뾶��ȣ�ǰ�ߴ�
B. X��N����Ԫ�ص��⻯��ķе���ȣ�ǰ�߽ϵ�
C. M��X��ԭ��������7
D. Z���ʾ����ܽ���Y�����������N���⻯���ˮ��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��A��B��C��D��E��G��ԭ����������������Ԫ�����ڱ���A��ԭ�Ӱ뾶��С��ϡ������Ԫ�س��⣩��B��C������C�������������Ǵ�����3����C��D������������֮����G��������������ȣ�E�ǵؿ��к������Ľ���Ԫ�ء��ش��������⣺
��1��C��Ԫ�����ڱ��е�λ����_________���ڡ�_________�壻G��Ԫ�ط�����_________��
��2��B��ԭ�ӽṹʾ��ͼ��_________��C��D��ɵļȺ����Ӽ��ֺ����ۼ��Ļ��������ʽ��_________��
��3��E��������D������������ˮ����Ũ��Һ��Ӧ�ų���������Ӧ�Ļ�ѧ����ʽ��__________________������������Ԫ���е�������ɵ�ij���Σ�ˮ��Һ�Լ��ԣ���������Һ���������ữ��KI������Һ�У���Һ��Ϊ��ɫ����Ӧ�����ӷ���ʽ��__________________��
��4����A��B��C��E�е�ijЩԪ����ɵĻ�����X��Y��Z��W������ת����ϵ��

X��Y��Z��W�о�������Ԫ����ɣ�Z��һ��ǿ�ᣬ��Z�Ļ�ѧʽ��___________��Y��Һ�����W��Ӧ�����ӷ���ʽ��___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g)![]() 2HF(g)��270kJ������˵����ȷ����( )
2HF(g)��270kJ������˵����ȷ����( )
A. 2L����������ֽ��1L��������1L�ķ�������270kJ����
B. 1mol������1mol������Ӧ����2molҺ̬������ų�������С��270kJ
C. ����ͬ�����£�1mol������1mol�����������ܺʹ���2mol���������������
D. 1������������1���������ӷ�Ӧ����2����������ӷų�270kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����()
�����������м�����������Һ�ɼ�����Ԫ��
��˳-2-��ϩ�ͷ�-2-��ϩ�ļ��������ͬ
�۱�����ˮ��Ͽ����屽
�ܿ���������Ӧ���ּ������ȩ
A.ֻ�Тٺ͢�B.ֻ�Тں͢�C.ֻ�Тٺ͢�D.�٢ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com