
【题目】用![]() 溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )
溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )
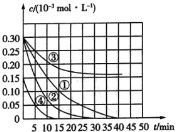
实验编号 | 温度(K) | pH |
① | 298 | 1 |
② | 310 | 1 |
③ | 298 | 7 |
④ | 298 | 1 |
A.实验①在15min内M的降解速率为![]()
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快
科目:高中化学 来源: 题型:
【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)![]() Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
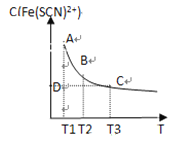
A. FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为Fe3+(aq)+SCN—(aq)![]() Fe(SCN)2+(aq) ΔH >0
Fe(SCN)2+(aq) ΔH >0
B. 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C. 反应处于D点时,一定有υ正>υ逆
D. A点与B点相比,A点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物H的一种合成路线如下:
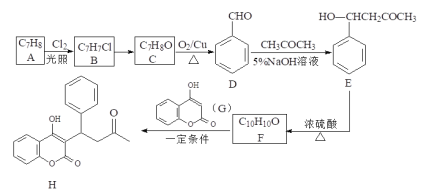
回答下列问题:
(1)A的名称是______________;G中含氧官能团名称是_____________________。
(2)F→H的反应类型为______________。B→C的试剂和条件是_____________。
(3)H的多种同分异构体在下列哪种仪器中显示信号完全相同____________(填字母)。
A.质谱仪 B.元素分析仪 C.红外光谱仪 D.核磁共振氢谱仪
(4)写出D→E的化学方程式_________________________________。
(5)在E的同分异构体中,同时满足下列条件的结构有_____________种。
①既能发生银镜反应,又能发生水解反应;②属于芳香族化合物;③苯环上只有2个取代基
(6)参照上述流程,以D和乙醛为原料合成![]() (其他无机试剂自选),设计合成路线:____________________________________________________________。
(其他无机试剂自选),设计合成路线:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国 在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现。某种兴奋剂的结构如下。关于它的说法正确的是( )
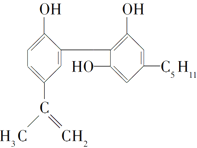
A.它的化学式为C19H24O3B.lmol该有机物能与3mol NaOH 反应
C.-C5H11有9种同分异构体D.属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺(![]() )是一种重要的有机合成中间体,熔点-6.3°C,沸点184 °C,易溶于乙醚(沸点34.6 °C,密度0.7135g/cm3),稍溶于水,用水蒸气蒸馏时会随水蒸气一并馏出。实验室常用硝基苯铁粉还原法制备苯胺,反应如下∶
)是一种重要的有机合成中间体,熔点-6.3°C,沸点184 °C,易溶于乙醚(沸点34.6 °C,密度0.7135g/cm3),稍溶于水,用水蒸气蒸馏时会随水蒸气一并馏出。实验室常用硝基苯铁粉还原法制备苯胺,反应如下∶
![]()
![]()
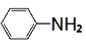
(一)制备∶
如图i所示,在仪器A中加入铁粉、水和冰醋酸,搅拌使其充分混合。通入冷却水,用滴液漏斗分批加入10.5mL(12.3g)硝基苯,边加边搅拌,待硝基苯加完、反应趋向和缓后,微热、回流50- -60 min。
(1)仪器A的名称为______,冷却水由球形冷凝管口______(填“a"或“b")通入;
(2)分批加入硝基苯是因为该反应为________(填“吸热”或“放热”)反应;
(3)为判断反应是否完成,可用长吸管吸出少量A中液体,加_______ ( 填“NaOH溶液”或“盐酸”)中,若看不到油珠,表明反应已完成。
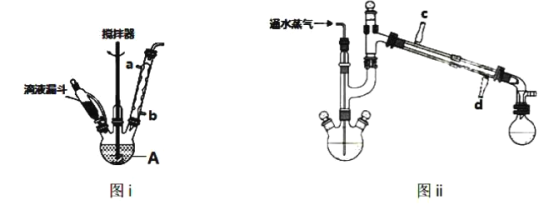
(二)提纯∶ ∶
①将回流装置改为水蒸气蒸馏装置(如图ii所示)进行水蒸气蒸馏,收集馏出液;②将馏出液移至仪器B中,静置、初步分离出有机层∶③水层加NaCl固体至饱和,用20mL乙醚分三次萃取,将乙醚萃取液与有机层合并;④向合并的有机液中加入粒状氢氧化钠;⑤先水浴蒸馏除去乙醚,再加热蒸馏,收集180~185°C的馏分。
(4)步骤①中水蒸气蒸馏作用为_______________________;
(5)步骤②中仪器B的名称为________________________;
(6)步骤③中加NaCl固体的作用有_______________、______________;
(7)步骤④中加粒状氢氧化钠的作用是__________________;
(8)步骤⑤中共收集到6.5g苯胺,则产率约为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
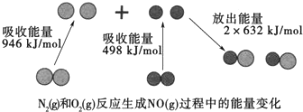
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)
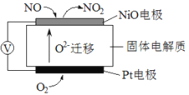
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。
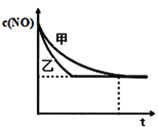
(4)在容积固定的绝热容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
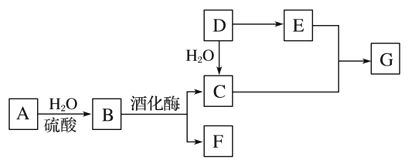
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com