
【题目】现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B____________; F_____________;
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为_____________
(3)①、④离子方程式:________________;________________。
【答案】Al FeCl2 2Na2O2+2CO2= 2Na2CO3+O2 2Na+2H2O =2NaOH+H2↑ Fe3+ +3OH- =Fe(OH)3
【解析】
焰色反应呈黄色的金属单质A是Na,Na与水发生产生氢气和NaOH,所以气体甲是H2,物质I是NaOH,可以与NaOH溶液反应的金属B是Al,H2与Cl2反应产生气体丙是HCl,HCl溶于水得到的物质E是盐酸,盐酸与金属单质C反应产生的物质F可以与氯气发生反应,说明该金属具有可变的化合价,生成物G与NaOH溶液反应产生红褐色沉淀H,则H是Fe(OH)3,G是FeCl3,F是FeCl2,所以金属C是Fe,据以上分析解答。
焰色反应呈黄色的金属单质A是Na,Na与水发生产生氢气和NaOH,所以气体甲是H2,物质I是NaOH,可以与NaOH溶液反应的金属B是Al,H2与Cl2反应产生气体丙是HCl,HCl溶于水得到的物质E是盐酸,盐酸与金属单质C反应产生的物质F可以与氯气发生反应,说明该金属具有可变的化合价,生成物G与NaOH溶液反应产生红褐色沉淀H,则H是Fe(OH)3,G是FeCl3,F是FeCl2,所以金属C是Fe,
(1)结合以上分析可知,物质B的化学式是Al;物质F的化学式是FeCl2;
(2)A的一种氧化物可以做核潜艇的供氧剂,则该氧化物是Na2O2,其作供氧时的化学方程式为2Na2O2+2CO2= 2Na2CO3+O2;
(3)①钠与水发生反应产生氢氧化钠和氢气,反应的离子方程式是:2Na+2H2O =2NaOH+H2↑;
④氢氧化钠与FeCl3发生反应产生氢氧化铁沉淀和氯化钠,反应的离子方程式是Fe3+ +3OH- =Fe(OH)3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
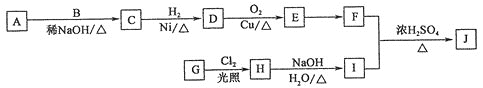
【题目】辣椒素酯具有促进体内脂肪氧化的功能,可用于治疗肥胖症,合成某辣椒素酯J(![]() )的流程如图所示。A、B、E中的含氧官能团种类相同,A和B核磁共振氢谱均有2个峰,A相对分子质量比B的大。
)的流程如图所示。A、B、E中的含氧官能团种类相同,A和B核磁共振氢谱均有2个峰,A相对分子质量比B的大。
已知: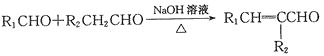
⑴J中官能团除羟基外还有________,G→H的反应类型为________。
⑵D的结构简式为______________,A的名称是________________。
⑶写出H→I的化学反应方程式:_______________________________________________。
⑷E有多种同分异构体,其中满足下列条件的有________种,写出核磁共振氢谱有3个峰的物质的结构简式:__________________。
①分子中含有两个甲基②含有碳氧双键
⑸以乙醛为基本原料,经三步反应制备![]() 氯丁酸,仿照上述表达方式,写出相应的流程图:____________________________________。
氯丁酸,仿照上述表达方式,写出相应的流程图:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国 在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现。某种兴奋剂的结构如下。关于它的说法正确的是( )
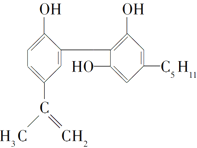
A.它的化学式为C19H24O3B.lmol该有机物能与3mol NaOH 反应
C.-C5H11有9种同分异构体D.属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
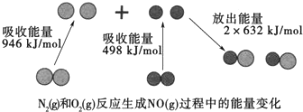
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)
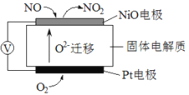
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
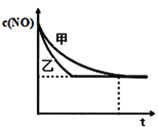
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。
(4)在容积固定的绝热容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):
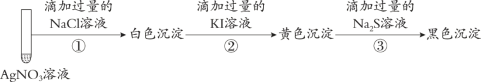
下列说法不正确的是
A. 实验①白色沉淀是难溶的AgCl B. 由实验②说明AgI比AgCl更难溶
C. 若按①③顺序实验,看不到黑色沉淀 D. 若按②①顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海水综合利用的示意图如下,下列说法正确的是( )
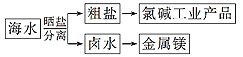
①通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等
②除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
③可将MgCl2·6H2O晶体在空气中直接加热脱水得到较纯净的无水MgCl2
④电解MgCl2溶液可制取金属镁
A.①③B.②④C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X2(g)+Y2(g)![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.4mol·L-1
B.X2为0.2 mol·L-1
C.Y2为0.4 mol·L-1
D.Z为0.3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com