
【题目】已知:X2(g)+Y2(g)![]() 2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
2Z(g),X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.4mol·L-1
B.X2为0.2 mol·L-1
C.Y2为0.4 mol·L-1
D.Z为0.3 mol·L-1
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B____________; F_____________;
(2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为_____________
(3)①、④离子方程式:________________;________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一,如图为锌锰干电池的构造示意图,锌锰干电池的负极材料是________(填物质名称),负极发生的电极反应为_____________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为________。
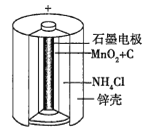
(2)目前常用的镍镉(Ni-Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
①该电池可以在酸性条件下进行充、放电
②该电池放电时,负极的电极反应式为Cd-2e-+2OH-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能
(3)如图为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的________(填“正”或“负”)极,X极的电极反应式为_________。
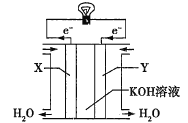
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.8×10-10mol2/L2,Ksp(AgI)=1.0×10-16 mol2/L2。下列说法中正确的是
A. 在相同温度下AgCl的溶解度小于AgI的溶解度
B. AgCl和AgI都不溶于水,因此AgCl和AgI不能相互转化
C. 常温下,AgC1若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol/L
×10-11mol/L
D. 将足量的AgCl分别放入下列物质中:①20mL0.01mol/LKCl溶液 ②10mL0.02mol/LCaCl2溶液 ③30mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的顺序为: ③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体Na2SO3受热易分解,实验流程和结果如下:
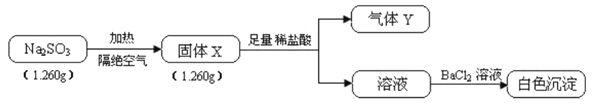
气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1、请回答:
(1)气体Y分子的电子式___,白色沉淀的化学式_______。
(2)该流程中的Na2SO3受热分解的化学方程式__________。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式____________(不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH-H键吸收的能量为436kJ,形成1molN-H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3可知,高温、高压条件下,1molN2完全反应放出的能量为92.4kJ,则断开1molN
2NH3可知,高温、高压条件下,1molN2完全反应放出的能量为92.4kJ,则断开1molN![]() N键吸收的能量是( )
N键吸收的能量是( )
A.431kJB.649kJC.869kJD.945.6kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol
CO2(g)+H2(g) H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol。
CO2(g)+4H2(g) H3=____ kJ/mol。
(2)反应Ⅰ达到平衡的标志是_____。
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是____。
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=___(以k正、k逆表示)。若该条件下k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=__kPa·s-1(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,已知Ka(CH3COOH)=Kb(NH3H2O)。关于浓度均为0.1mol·L-1的醋酸和氨水的两种溶液的说法正确的是( )
①两溶液的pH之和为14
②两溶液中醋酸和NH3H2O的电离程度相同
③两溶液加水稀释,溶液中各离子浓度均降低
④两溶液等体积混合,pH=7,由水电离出c(H+)=1×10-7mol·L-1
A.①②B.②④C.①②④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com