
����Ŀ������ʱ����֪Ka(CH3COOH)=Kb(NH3H2O)������Ũ�Ⱦ�Ϊ0.1mol��L-1�Ĵ���Ͱ�ˮ��������Һ��˵����ȷ���ǣ� ��
������Һ��pH֮��Ϊ14
������Һ�д����NH3H2O�ĵ���̶���ͬ
������Һ��ˮϡ�ͣ���Һ�и�����Ũ�Ⱦ�����
������Һ�������ϣ�pH=7����ˮ�����c(H+)=1��10-7mol��L-1
A.�٢�B.�ڢ�C.�٢ڢ�D.�٢ڢۢ�
���𰸡�A
��������
����ʱ��0.1mol��L-1�Ĵ���Ͱ�ˮ��Һ��Ka=![]() ��Kb=
��Kb=![]() ����֪Ka(CH3COOH)=Kb(NH3H2O)��c(CH3COOH)=c(NH3H2O)����c(H+)(CH3COOH)= c(OH-)(NH3H2O)��
����֪Ka(CH3COOH)=Kb(NH3H2O)��c(CH3COOH)=c(NH3H2O)����c(H+)(CH3COOH)= c(OH-)(NH3H2O)��
�������Ϸ���֪��c(H+)(CH3COOH)= c(OH-)( NH3H2O)����pH(CH3COOH)=pOH(NH3H2O)=14- pH(NH3H2O)������pH(CH3COOH)+ pH(NH3H2O)=14������ȷ��
������Һ�д����NH3��H2O����ʼŨ�ȶ�Ϊ0.1mol��L-1��c(H+)(CH3COOH)= c(OH-)( NH3H2O)�����Ե���̶���ͬ������ȷ��
������Һ��ˮϡ�ͣ�������Һ�е�c(OH-)����ˮ�е�c(H+)���۲���ȷ��
������Һ�������ϣ�pH=7����ʱ����CH3COONH4������˫ˮ�ⷴӦ���ٽ�ˮ�ĵ��룬������ˮ�����c(H+)>1��10-7mol��L-1���ܲ���ȷ��
�ۺ����Ϸ������٢���ȷ����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X2(g)+Y2(g)![]() 2Z(g)��X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol��L��1��0.3 mol��L��1��0.2 mol��L��1����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ�����
2Z(g)��X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol��L��1��0.3 mol��L��1��0.2 mol��L��1����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ�����
A.ZΪ0.4mol��L��1
B.X2Ϊ0.2 mol��L��1
C.Y2Ϊ0.4 mol��L��1
D.ZΪ0.3 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д��������̣�����һ���¶��µ��ܱ������д������·�Ӧ��2SO2(g) + O2(g)![]() 2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
��1����SO2ת����Ϊ50��ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬��________����δ�ﵽ���ĸ�������У�__________
��2����ƽ��״̬ʱ�� SO2��ת����ӦΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��·��������ҵ��ˮ����������������ŷŵ���ˮ�����±���ʾ��Ϊ�о���ˮ��Cu2+���������pH��ȡ5�ݵ����ķ�ˮ���ֱ���30%��NaOH��Һ����pH��8.5��9��9.5��10��11�����ú����ϲ���Һ��ͭԪ�صĺ�����ʵ��������ͼ��ʾ���������ϣ�
ƽ���![]()
ƽ���![]()
��Ŀ | ��ˮˮ�� | �ŷű� |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ��0.5 |
NH4+/mgL-1 | 2632 | ��15 |
����˵��������ǣ� ��
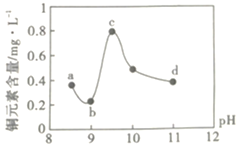
A.a~b�η����ķ�ӦΪ��![]()
B.b~c�Σ���pH���ߣ�Cu(OH)2�������ӣ�����ƽ��������ƶ���ͭԪ�غ�������
C.c~d�Σ���pH���ߣ�c(OH-)���ӣ�ƽ��������ƶ���ͭԪ�غ����½�
D.d���Ժ���c(OH-)���ӣ�ͭԪ�غ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25Cʱ,0.1mol/L��3����Һ������ڰ�ˮ��CH3COONa��Һ������˵����,����ȷ����
A. 3����Һ��pH��С���Ǣ�
B. 3����Һ��ˮ�ĵ���̶������Ǣ�
C. ����ڵ������Ϻ���Һ������
D. ����۵������Ϻ�c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ�������X��Y��Z������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������
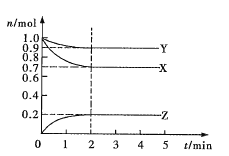
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
(2)��Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ_________��
(3)����������˵��������Ӧ�ﵽ��ѧƽ��״̬����________(�����)
A.�������������ʵ�������ʱ��ı仯���仯
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����![]() X��ͬʱ����
X��ͬʱ����![]() Z
Z
D.������������������ʱ��ı仯���仯
E.���������ܶȲ��ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���ӦX2��g����Y2��g��![]() 2XY��g�� ��H<0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ����( )
2XY��g�� ��H<0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ����( )
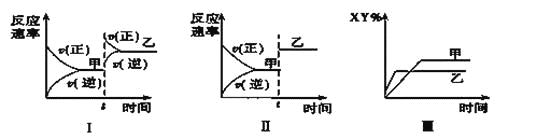
A. ͼ��������ѹǿ�ı仯���
B. ͼ����һ���Ǽ�������ı仯���
C. ͼ��������ѹǿ�������¶ȵı仯���
D. ͼ��һ���������¶ȵı仯���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4��������CO2�����ɵõ�����CO�����壬�����������ֻ�����Ʒ���ü����еĻ�ѧ��ӦΪ��CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ��H=+330kJ/mol
2H2O(g)+4CO(g) ��H=+330kJ/mol
��1����ͼ��ʾ��ʼͶ�ϱ�n(CH4):n(CO2)Ϊ1:3��1:4��CH4��ת�����ڲ�ͬ�¶ȣ�T1��T2������ѹǿ�Ĺ�ϵ��[ע��Ͷ�ϱ���a1��a2��ʾ]

��a2=__________��
���ж�T1��T2�Ĵ�С��ϵ����˵�����ɣ�__________��
��2��CH4��������CO2�Ĵ�ת��ԭ��ʾ��ͼ���£�

�ٹ��̢�����1mol H2ʱ����123.5kJ���������Ȼ�ѧ����ʽ��__________��
�ڹ��̢�ʵ���˺��������뺬̼���ֵķ��롣����H2O(g)�Ļ�ѧ����ʽ��__________��
�ۼ�����̢���̢��еĸ�����ת����ȫ������˵����ȷ����__________��������ţ�
a�����̢���̢��з�����������ԭ��Ӧ
b�����̢���ʹ�õĴ���ΪFe3O4��CaCO3
c�������̢�Ͷ��![]() ���ɵ��¹��̢��д���ʧЧ
���ɵ��¹��̢��д���ʧЧ
���𰸡� 1:4 T2>T1 ����ӦΪ���ȷ�Ӧ���¶�����ʱ�����ת�������� CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
��������(1). ��.����ͬ�����£�Ͷ�ϱ�ԽС�������ת����Խ��ͼ��֪��a2��a1����a2��ʾ����1:4ʱ�����ת�������ʴ�Ϊ��1:4��
��. ��CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)������ӦΪ���ȷ�Ӧ���¶�����ʱ��ƽ�������ƶ��������ת����������T2>T1���ʴ�Ϊ��T2>T1������ӦΪ���ȷ�Ӧ���¶�����ʱ�����ת����������
2H2O(g)+4CO(g)������ӦΪ���ȷ�Ӧ���¶�����ʱ��ƽ�������ƶ��������ת����������T2>T1���ʴ�Ϊ��T2>T1������ӦΪ���ȷ�Ӧ���¶�����ʱ�����ת����������
(2). ��.�ڹ���I�У�����1mol H2ʱ����123.5kJ��������ͼ��֪�����Ȼ�ѧ����ʽΪ��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=+247kJ/mol���ʴ�Ϊ��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=+247kJ/mol��
��. �ɹ���II��ת����ϵ��������������е�H2��Fe3O4��ԭΪFe����Ӧ����ʽΪ��4H2+Fe3O4 ![]() 3Fe+4H2O���ʴ�Ϊ��4H2+Fe3O4
3Fe+4H2O���ʴ�Ϊ��4H2+Fe3O4 ![]() 3Fe+4H2O��
3Fe+4H2O��
��. a. �������̶���Ԫ�ػ��ϼ۵ĸı䣬��������������ԭ��Ӧ����a��ȷ��b. ����II��Fe3O4���ձ���ԭΪFe��Fe3O4���Ǵ�������b����c. ����ʼͶ�ϱ�![]() ʱ������ǡ�ð����������ʽ��Ӧ����CO2���ɣ�����CaCO3���μӷ�Ӧ��ʹ�����ж�ʧЧ����c��ȷ����ѡac��
ʱ������ǡ�ð����������ʽ��Ӧ����CO2���ɣ�����CaCO3���μӷ�Ӧ��ʹ�����ж�ʧЧ����c��ȷ����ѡac��
�����͡�������
��������
17
����Ŀ������ũҵ��ˮ�Լ�������ˮ��Ũ�Ƚϸߵ�![]() ����ɵ���Ⱦ����ҵ�ϴ���ˮ����
����ɵ���Ⱦ����ҵ�ϴ���ˮ����![]() ��һ�ַ������������ѧ��ԭ����ij��ѧС���÷���м����������Һģ��˹��̣�ʵ�����¡�
��һ�ַ������������ѧ��ԭ����ij��ѧС���÷���м����������Һģ��˹��̣�ʵ�����¡�
��1������ϡ����ϴȥ����м��������⣬Ȼ��������ˮ����мϴ����
�ٳ��ⷴӦ�����ӷ���ʽ��__________��
���ж���мϴ���ķ�����__________��
��2����KNO3��Һ��pH����2.5����������ԭ�ĽǶȷ���������ҺpH��ԭ����__________��
��3����������������������мͶ�루2������Һ�С���ͼ��ʾ�÷�Ӧ�����У���ϵ���������Ũ�ȡ�pH��ʱ��仯�Ĺ�ϵ�������ͼ����Ϣ�ش�

��t1ʱ��ǰ�÷�Ӧ�����ӷ���ʽ��__________��
��t2ʱ�̺÷�Ӧ���ڽ��У���Һ��![]() ��Ũ��������Fe2+��Ũ��ȴû�������ܵ�ԭ����__________��
��Ũ��������Fe2+��Ũ��ȴû�������ܵ�ԭ����__________��
��4����м��KNO3��Һ��Ӧ����������Һ�м���̿�ۣ���������÷�Ӧ�����ʣ����![]() ��ȥ��Ч������ԭ����__________��
��ȥ��Ч������ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ��(��Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO |
����ƽ�� ����(Ka) | 7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | 3.0��10-8 |
(1)��Ũ��Ϊ0.1mol��L-1HF��Һ��ˮϡ��һ��(�����¶Ȳ���)�����и����������___��
A��c(H+) B��c(H+)��c(OH-) C��![]() D��
D��![]()
(2)25��ʱ����20mL0.1mol��L-1������м���VmL0.1mol��L-1NaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����___��
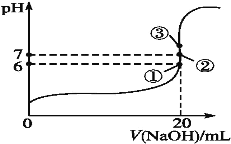
A��pH=3��HF��Һ��pH=11��NaF��Һ�У���ˮ�������c(H+)���
B���ٵ�ʱpH=6����ʱ��Һ��c(F-)-c(Na+)=9.9��10-7mol��L-1
C���ڵ�ʱ����Һ�е�c(F-)=c(Na+)
D���۵�ʱV=20mL����ʱ��Һ��c(F-)<c(Na+)=0.1mol��L-1
(3)���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ����Na2CO3��Һ����NaHCO3��Һ����NaF��Һ����NaClO��Һ�����������ж�pH�ɴ�С����___��
(4)Na2CO3��Һ�Լ�������Ϊ![]() ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
(5)����������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO��ṹʽΪH-O-F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A��ÿ����1molHFת��___mol���ӡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com