
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
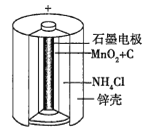
(1)锌锰干电池是应用最普遍的电池之一,如图为锌锰干电池的构造示意图,锌锰干电池的负极材料是________(填物质名称),负极发生的电极反应为_____________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为________。
(2)目前常用的镍镉(Ni-Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
①该电池可以在酸性条件下进行充、放电
②该电池放电时,负极的电极反应式为Cd-2e-+2OH-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能
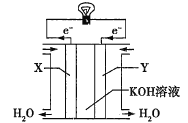
(3)如图为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的________(填“正”或“负”)极,X极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
反应Ⅱ:CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=﹣41 kJ/mol
CO2(g)+H2(g) H2=﹣41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol。
CO2(g)+4H2(g) H3=____ kJ/mol。
(2)反应Ⅰ达到平衡的标志是_____。
A.恒温恒容情况下,压强不再改变 B.v正(CO)=3v逆(H2)
C.平均相对分子质量不再改变 D.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加CO转化率的是____。
A.升高温度 B.将CO2从体系分离
C.充入He,使体系总压强增大 D.按原投料比加倍投料
(4)将1 mol CH4(g)和1 mol H2O(g)加入恒温恒压的密闭容器中(温度298 K、压强100 kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=___(以k正、k逆表示)。若该条件下k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=__kPa·s-1(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
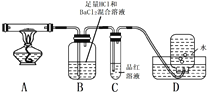
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:
(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100molL-1AgNO3滴定500mL0.0500molL-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
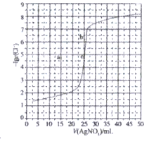
A.曲线上各点的溶液满足关系式c(Ag+)c(Cl-)= Ksp(AgCl)
B.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
C.相同实验条件下,若改为0.0500molL-1Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400molL-1Cl-,反应终点c移到a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,已知Ka(CH3COOH)=Kb(NH3H2O)。关于浓度均为0.1mol·L-1的醋酸和氨水的两种溶液的说法正确的是( )
①两溶液的pH之和为14
②两溶液中醋酸和NH3H2O的电离程度相同
③两溶液加水稀释,溶液中各离子浓度均降低
④两溶液等体积混合,pH=7,由水电离出c(H+)=1×10-7mol·L-1
A.①②B.②④C.①②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
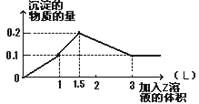
A.偏铝酸钠、氢氧化钡、硫酸
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com