
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:
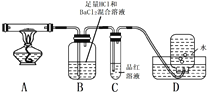
(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
【答案】加快反应速率 蒸发皿 有晶膜出现(或大量固体出现时) 防止硫酸亚铁水解 2 1 4 2 1 5 红棕 Ba2++SO3+H2O=BaSO4↓+2H+(说明:分步写也给分2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+也给分) 检验产物中是否含有SO2 不能 取B中少量溶液于试管中,滴加少量NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体
【解析】
I.(1) 适当加热使溶液温度升高,可加快反应速率;
(2)加入饱和的硫酸铵溶液后直接加热蒸发,加热溶液至有晶膜出现(或大量固体出现时),停止加热;溶液一直保持强酸性防止硫酸亚铁水解;
Ⅱ.(3)根据化合价升降法配平;
(4) 加热过程,A逐渐变为氧化铁;
(5) B为酸性溶液,二氧化硫、氧气与氯化钡反应生成少量硫酸钡白色沉淀;
(6)C中品红溶液可以二氧化硫反应,导致溶液褪色;
(7)D中集气瓶能收集到SO2和少量的O2;
(8)溶液B显酸性,氨气能够在此装置中被吸收,检验B中是否含有铵根离子即可。
I.(1) 适当加热使溶液温度升高,可加快反应速率;
(2)加入饱和的硫酸铵溶液后直接加热蒸发,则滤液转移到蒸发皿中;加热溶液至有晶膜出现(或大量固体出现时),停止加热,利用余热进行蒸发结晶;为防止硫酸亚铁水解,溶液一直保持强酸性;
Ⅱ.(3)反应中Fe的化合价由+2变为+3,N的化合价由-3变为0,S的化合价由+6变为+4,根据原子守恒,硫酸亚铁铵的系数为2,SO2的系数为4,则电子转移总数为8,Fe得到2个电子,产生1个氮气,得到6个电子,则系数分别为2、1、4、2、1、5;
(4) 加热过程,A逐渐变为氧化铁,固体为红棕色;
(5) B为酸性溶液,二氧化硫、氧气与氯化钡反应生成少量硫酸钡白色沉淀,离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+;
(6)C中品红溶液可与二氧化硫反应,导致溶液褪色,则可检验二氧化硫的存在;
(7)D中集气瓶能收集到SO2和少量的O2,不能使带火星的木条燃烧;
(8)溶液B显酸性,氨气能够在此装置中被吸收,检验B中是否含有铵根离子即可,方法为取B中少量溶液于试管中,滴加少量NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体。


科目:高中化学 来源: 题型:
【题目】下列说祛正确的是
A. 蛋白质是仅由碳、氢、氧、氯元素组成的一类高分子化合物
B. 可以用溴水鉴别![]() 和
和![]()
C. 用甲苯分别制取TNT、邻溴甲苯和苯甲酸所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()
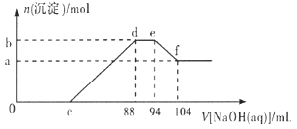
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0L X mol/L CH3COOH溶液与0.1mol NaOH固体混合充分反应,再向该混合溶液中通人HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列说法正确的是
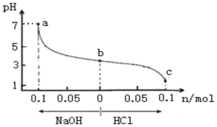
A.X<0.1
B.b→a过程中,水的电离程度逐渐增大
C.Ka (CH3COOH) =10-8/(X-0.1)
D.b→c过程中,c(CH3COOH)/c(CH3COO) 逐渐变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g),已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态?________,若未达到,哪个方向进行?__________
(2)达平衡状态时, SO2的转化率应为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是 ( )
A. NaOH的电子式:![]()
B. I4O9(碘酸碘)中碘的化合价为+1、+5
C. NH5的结构与NH4Cl相似,NH5的结构式为
D. 离子结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
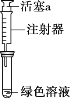
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO
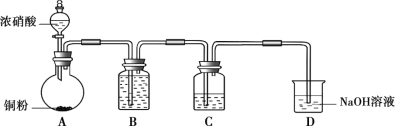
①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com