
����Ŀ��ij��·��������ҵ��ˮ����������������ŷŵ���ˮ�����±���ʾ��Ϊ�о���ˮ��Cu2+���������pH��ȡ5�ݵ����ķ�ˮ���ֱ���30%��NaOH��Һ����pH��8.5��9��9.5��10��11�����ú����ϲ���Һ��ͭԪ�صĺ�����ʵ��������ͼ��ʾ���������ϣ�
ƽ���![]()
ƽ���![]()
��Ŀ | ��ˮˮ�� | �ŷű� |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ��0.5 |
NH4+/mgL-1 | 2632 | ��15 |
����˵��������ǣ� ��
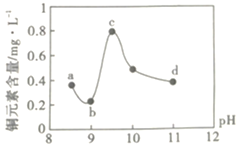
A.a~b�η����ķ�ӦΪ��![]()
B.b~c�Σ���pH���ߣ�Cu(OH)2�������ӣ�����ƽ��������ƶ���ͭԪ�غ�������
C.c~d�Σ���pH���ߣ�c(OH-)���ӣ�ƽ��������ƶ���ͭԪ�غ����½�
D.d���Ժ���c(OH-)���ӣ�ͭԪ�غ�����������
���𰸡�B
��������
A. a~b��ͭԪ�غ�����С���γ�Cu(OH)2������
B. ����������ӣ���Ӱ��ƽ����ƶ���
C. ���Ũ�ȶ�ƽ���ƶ���Ӱ�������
D. ���c(OH-)��ƽ��II��Ӱ�������
A. a~b��ͭԪ�غ�����С���γ�Cu(OH)2��������˷����ķ�ӦΪ![]() ��A����ȷ�����������⣻
��A����ȷ�����������⣻
B. b~c�Σ�����c(OH-)����NH4+��OH-�������NH3H2O������Ũ������![]() ��ƽ��������У���Һ��[Cu(NH3)4]2+Ũ������B����������⣻
��ƽ��������У���Һ��[Cu(NH3)4]2+Ũ������B����������⣻
C. c~d�Σ���c(OH-)����![]() ������У�c(Cu2+)��С��ͭԪ�غ������ͣ�C����ȷ�����������⣻
������У�c(Cu2+)��С��ͭԪ�غ������ͣ�C����ȷ�����������⣻
D. d���Ժ���c(OH-)���ӣ�![]() ������У��ϲ���Һ��ͭԪ�صĺ���������D����ȷ�����������⣻
������У��ϲ���Һ��ͭԪ�صĺ���������D����ȷ�����������⣻
��ѡB��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ksp(AgCl)=1.8��10-10mol2/L2��Ksp(AgI)��1.0��10-16 mol2/L2������˵������ȷ����
A. ����ͬ�¶���AgCl���ܽ��С��AgI���ܽ��
B. AgCl��AgI��������ˮ�����AgCl��AgI�����ת��
C. �����£�AgC1��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����![]() ��10-11mol/L
��10-11mol/L
D. ��������AgCl�ֱ��������������:��20mL0.01mol/LKCl��Һ ��10mL0.02mol/LCaCl2��Һ ��30mL0.05mol/LAgNO3��Һ��AgCl���ܽ���ɴ�С��˳��Ϊ�� ��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2�ڹ�ҵ�ϳ���Ϊ��Ҫ�Ļ���ԭ�ϣ���������Ϊ�ϳ�������ҵ��CH4��H2O��������Ŀǰ���ģ��ȡ�ϳ�������Ҫ��������ԭ��Ϊ��
��Ӧ��CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+210 kJ/mol
CO(g)+3H2(g) H1=+210 kJ/mol
��Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=��41 kJ/mol
CO2(g)+H2(g) H2=��41 kJ/mol
(1)CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) H3=____ kJ/mol��
CO2(g)+4H2(g) H3=____ kJ/mol��
(2)��Ӧ��ﵽƽ��ı�־��_____��
A�����º�������£�ѹǿ���ٸı䡡��B��v��(CO)=3v��(H2)
C��ƽ����Է����������ٸı䡡������D�����º�������£������ܶȲ��ٸı�
(3)�������ݻ����䣬�����Ƿ�Ӧ�Է�Ӧ�����д�ʩ������COת���ʵ���____��
A�������¶ȡ�������������������������B����CO2����ϵ����
C������He��ʹ��ϵ��ѹǿ����������D����ԭͶ�ϱȼӱ�Ͷ��
(4)��1 mol CH4(g)��1 mol H2O(g)������º�ѹ���ܱ�������(�¶�298 K��ѹǿ100 kPa)��������Ӧ�����Ƿ�Ӧ��ķ������÷�Ӧ�У�����Ӧ����v��=k����p(CH4)��p(H2O)���淴Ӧ����v��=k����p(CO)��p3(H2)������k����k��Ϊ���ʳ�����pΪ��ѹ(��ѹ=��ѹ�����ʵ�������)����÷�Ӧ��ѹǿƽ�ⳣ��Kp=___(��k����k����ʾ)������������k��=4.4��104kPa-1��s-1����CH4�ֽ�20%ʱ��v��=__kPa��s-1��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ����������ͨ�����Ϊ2L���ܱ������У�ʹ�䷢����Ӧ�����й�����X��Y��Z�����ʵ����ı仯��ͼ��ʾ���������й��ƶ���ȷ���ǣ� ��

A. �÷�Ӧ�Ļ�ѧ����ʽΪ�� 3Z = 3X+2Y
B. t0ʱ��X��Y��Z���������ٸı�
C. t0ʱ��Z��Ũ��Ϊ1.2 mol/L
D. t0ʱ����Ӧֹͣ����Ӧ����Ϊ0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100molL-1AgNO3�ζ�500mL0.0500molL-1Cl-��Һ�ĵζ�������ͼ��ʾ�������й�����������ǣ� ��
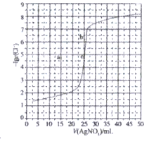
A.�����ϸ������Һ�����ϵʽc(Ag+)c(Cl-)= Ksp(AgCl)
B.�����������ݼ����֪Ksp(AgCl)��������Ϊ10-10
C.��ͬʵ�������£�����Ϊ0.0500molL-1Br-����Ӧ�յ�c��b�����ƶ�
D.��ͬʵ�������£�����Ϊ0.0400molL-1Cl-����Ӧ�յ�c�Ƶ�a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��·��������ҵ��ˮ����������������ŷŵ���ˮ�����±���ʾ��Ϊ�о���ˮ��Cu2+���������pH��ȡ5�ݵ����ķ�ˮ���ֱ���30%��NaOH��Һ����pH��8.5��9��9.5��10��11�����ú����ϲ���Һ��ͭԪ�صĺ�����ʵ��������ͼ��ʾ���������ϣ�
ƽ���![]()
ƽ���![]()
��Ŀ | ��ˮˮ�� | �ŷű� |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ��0.5 |
NH4+/mgL-1 | 2632 | ��15 |
����˵��������ǣ� ��
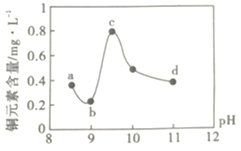
A.a~b�η����ķ�ӦΪ��![]()
B.b~c�Σ���pH���ߣ�Cu(OH)2�������ӣ�����ƽ��������ƶ���ͭԪ�غ�������
C.c~d�Σ���pH���ߣ�c(OH-)���ӣ�ƽ��������ƶ���ͭԪ�غ����½�
D.d���Ժ���c(OH-)���ӣ�ͭԪ�غ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����֪Ka(CH3COOH)=Kb(NH3H2O)������Ũ�Ⱦ�Ϊ0.1mol��L-1�Ĵ���Ͱ�ˮ��������Һ��˵����ȷ���ǣ� ��
������Һ��pH֮��Ϊ14
������Һ�д����NH3H2O�ĵ���̶���ͬ
������Һ��ˮϡ�ͣ���Һ�и�����Ũ�Ⱦ�����
������Һ�������ϣ�pH=7����ˮ�����c(H+)=1��10-7mol��L-1
A.�٢�B.�ڢ�C.�٢ڢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:pK=-lgK��25��ʱ����Ԫ��H2A��pK1=1.85��pK2=7.19��25��ʱ,��0.1mol/LNaOH��Һ�ζ�20mL0.1mol/LH2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ����

A. a��������Һ��:Vo=10mL
B. C��������Һ��:c(A2-)=c(HA-)
C. b��������Һ��:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d��������Һ��:A2-��ˮ��ƽ�ⳣ��K1=1��10-7.19
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�Ļ�ѧ��������ȷ����
A. ��п��(ZnS)��CuSO4��Һ���ú�ת��Ϊͭ��(CuS)��ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L �Ĵ�����ҺpHԼΪ3��CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. ���NaCl��Һ����������ҺpH����2H2O + 2e- === H2��+ 2OH-
D. ��������������ʴ��������ӦΪ��Fe��3e- === Fe3+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com