
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。
I.已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式__________________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),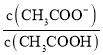 =_____。
=_____。
П.常温下有0.1 mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:

(4)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同)________。
【答案】Na2CO3>NaCN>CH3COONa NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7 18 ③>②>④>①
【解析】
(1)①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②电离平衡常数越大,酸的酸性越强,根据表中数据可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,据此写出反应的化学方程式;
(3)溶液中的电荷守恒来分析,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)-c(Na+)= +c(H+)-c(OH-),结合醋酸的电离常数计算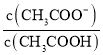 的大小;
的大小;
(4)等pH的酸,其电离程度越大,酸的物质的量浓度越小。
(1)根据图表数据分析,电离常数:CH3COOH>HCN> HCO3-,结合盐的水解规律可知:等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,水解程度越大,溶液的碱性就越强,所以溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
(2)根据电离平衡常数大小可知酸性:H2CO3>HCN>HCO3-,向NaCN溶液中通入少量CO2,反应生成HCN和碳酸氢钠,不能生成CO2,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;
(3)25℃时,CH3COOH和CH3COONa的混合溶液,若测得混合液的pH=6,即c(H+)=10-6mol/L,由于水的离子积为10-14,可知c(OH-)=10-8mol/L;根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因此c(CH3COO-)-c(Na+)=c(H+)-c(OH-) =10-6mol/L-10-8mol/L=9.9×10-7mol/L,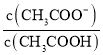 =
=![]() =
=![]() =18;
=18;
(4)等pH的酸,其电离程度越大,则需要的酸的物质的量浓度越小,根据表中数据可知,电离程度大小为:③<②<④<①,则四种溶液的物质的量浓度由大到小的顺序是③>②>④>①。


科目:高中化学 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如下图所示:
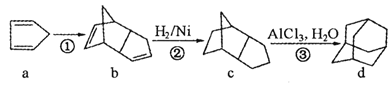
关于以上有机物的说法中,不正确的是
A. a分子中所有原子均在同一平面内 B. a和Br2按1:1加成的产物有两种
C. d的一氯代物有两种 D. c与d的分子式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯Ⅰ的合成路线如下:
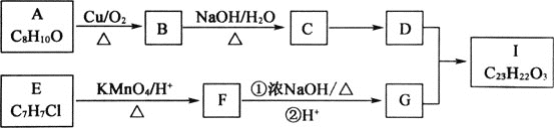
已知以下信息:
①A~I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]()
![]()
![]()
③2RCH2CHO![]()

请回答下列问题:
⑴A→B的反应类型为________,D所含官能团的名称为________,E的名称为________。
⑵E→F与F→G的顺序能否颠倒________![]() 填“能”或“否”
填“能”或“否”![]() ,理由是________。
,理由是________。
⑶B与银氨溶液反应的化学方程式为________。
⑷Ⅰ的结构简式为________。
⑸符合下列要求的A的同分异构体还有________种。
①与Na反应并产生H2
②芳香族化合物
⑹根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)_______。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
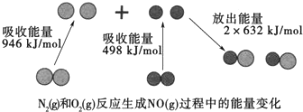
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)
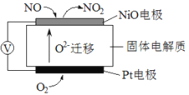
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。
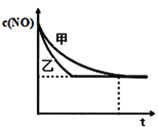
(4)在容积固定的绝热容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
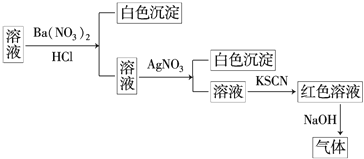
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某溶液A中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的五种离子,浓度均为
中的五种离子,浓度均为![]() 对A溶液进行以下实验,整个过程如图所示
对A溶液进行以下实验,整个过程如图所示![]() 部分产物省略
部分产物省略![]() ,反应
,反应![]() 后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是
后的溶液B与溶液A中的阴离子种类相同。下列结论正确的是![]()
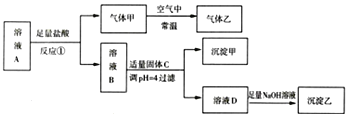
A.溶液B中存在的阴离子是![]() 、
、![]() 、
、![]()
B.固体C可能是MgO、![]() 或
或![]()
C.沉淀甲是![]() 、沉淀乙是
、沉淀乙是![]()
D.A中不能确定的离子是![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉,现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如图:
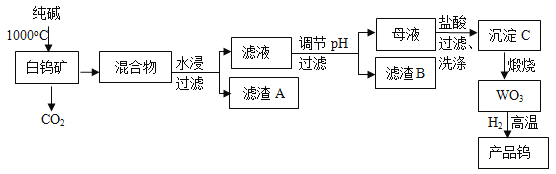
已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32﹣为8,WO42﹣为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:____。
(3)滤渣B的主要成分是(写化学式)___。调节pH可选用的试剂是:__(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C已经洗涤干净的操作是____。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是:___。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10﹣10,Ksp[Ca(OH)2]=4×10﹣7,当溶液中WO42﹣恰好沉淀完全(离子浓度等于10﹣5mol/L)时,溶液中c(OH﹣)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
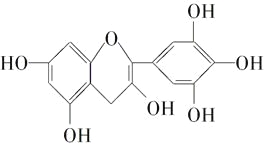
①分子式为C15H12O7
②1 mol儿茶素A在一定条件下最多能与7 molH2加成
③等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1∶1
④1 mol儿茶素A与足量的浓溴水反应,最多消耗4 mol Br2
A.①②B.①④C.②③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com