
【题目】某小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验 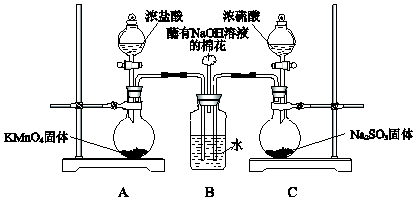
(1)装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中氧化剂和还原剂的物质的量之比是 , 生成71g Cl2时反应转移的电子是mol,装置C中生成SO2 , 反应的化学方程式是
(2)装置B中蘸有NaOH溶液的棉花的作用是
(3)SO2与Cl2同时通入水中反应的化学方程式是 .
【答案】
(1)1:5;2;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(2)尾气处理,防止污染空气
(3)SO2+Cl2+2H2O═2HCl+H2SO4
【解析】解:(1)元素化合价升高的失电子做还原剂,元素化合价降低的做氧化剂,装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是KMnO4 , 反应中氧化剂和还原剂的物质的量之比是1:5,生成氯气5mol×71g/mol=355g,电子转移10mol,则生成71g Cl2转移的电子是2mol,装置C中浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,所以答案是:1:5;2;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;(2)氯气有毒污染空气,不能排放需要用氢氧化钠吸收剩余氯气,装置B中蘸有NaOH溶液的棉花的作用是吸收氯气尾气处理,防止污染空气,
所以答案是:尾气处理,防止污染空气;(3)二氧化硫和氯气同时通入水中发生氧化还原反应生成了盐酸和硫酸,化学方程式为:SO2+Cl2+2H2O═2HCl+H2SO4 , 所以答案是:SO2+Cl2+2H2O═2HCl+H2SO4 .


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于固体物质:Cu、Si和Ne的说法中正确的是
A.Cu、Si和Ne三种晶体中,熔点最低的是Ne
B.晶体Mg属于金属晶体,其中Mg原子的堆积方式是面心立方最密堆积
C.1mol晶体Si中,含有4molSi—Si键
D.Si和Ne都是非金属元素,所以它们的晶体类型是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
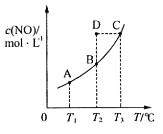
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.石油裂解可以得到氯乙烯
B.油脂水解可得到氨基酸和甘油
C.所有烷烃和蛋白质中都存在碳碳单键
D.淀粉和纤维素的组成都是(C6H10O5)n , 水解最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中反应:3Fe(s) +4H2O(g)=Fe3O4+4H2(g),下列条件的改变对其反应速率几乎无影响的是
A. 把铁块变成铁粉
B. 将容器的体积缩小一半
C. 压强不变,充入氮气使容器体积增大
D. 体积不变,充入氮气使容器压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符号3Px所代表的含义是:( )
A. Px轨道上有3个电子 B. 第三电子层Px轨道有3个伸展方向
C. Px电子云有3个伸展方向 D. 第三电子层沿x轴方向伸展的p轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某NaCl溶液中含有0.5molNa+ , 对该溶液的说法不正确的是( )
A.配制100mL该溶液需用5.85g NaCl
B.该溶液的物质的量浓度为1molL ﹣1
C.该溶液中含有58.5g NaCl
D.量取100mL该溶液,其中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸( ![]() =1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
=1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
(1)所需浓硫酸的体积为mL
(2)请将下列操作按正确的序号填在横线上:
A用量筒量取浓硫酸 B反复颠倒摇匀 C用胶头滴管加水至刻度线 D洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 E稀释浓硫酸 F将溶液转入容量瓶 G向容量瓶中加入适量蒸馏水至距离刻度线1~2cm处
其操作正确顺序为 .
(3)使用容量瓶前需要先进行操作的是 ,
(4)若实验中出现下列现象对所配溶液有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即进行定容 ,
②定容时俯视刻度线 ,
③配制前容量瓶内有水 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com