
【题目】按要求填空:
(1)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至______。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为_________,由水电离出的c(OH-)=________mol·L-1。
(3)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为_____。
【答案】5 CO32 + H2OHCO3- + OH- 1×103 1:10
【解析】
(1)根据Cr(OH)3溶度积计算要使c(Cr3+)完全沉淀时的氢氧根浓度,再计算氢离子浓度和pH值。
(2)碳酸钠溶液pH为11,是碳酸根水解生成碳酸氢根和氢氧根,先计算溶液中c(H+),再计算溶液中c(OH-),溶液中的氢氧根就是水电离出的氢氧根。
(3)计算出100℃时pH=3的硫酸溶液c(H+)和pH=10的NaOH溶液c(OH-),根据混合后溶液的pH=7,溶液呈碱性进行计算。
(1)常温下,Cr(OH)3溶度积Ksp=1.0×1032,要使c(Cr3+)完全沉淀,![]() ,
,![]() ,
,![]() ,pH =5,因此溶液的pH应调至5;故答案为:5。
,pH =5,因此溶液的pH应调至5;故答案为:5。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,是碳酸根水解生成碳酸氢根和氢氧根,其水解方程式为CO32 + H2OHCO3- + OH-,c(H+)=1×1011molL1,c(OH-)=1×103 molL1,溶液中的氢氧根就是水电离出的氢氧根,因此由水电离出的c(OH-)=1×103molL1;故答案为:CO32 + H2OHCO3- + OH-;1×103。
(3)在100℃下,将pH=3的硫酸溶液c(H+)=1×103molL1,pH=10的NaOH溶液c(OH-)=1×102 molL1混合,若要使混合后溶液的pH=7,溶液呈碱性,c(OH-)=1×105 molL1,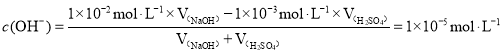 ,
,![]() ,则硫酸溶液和NaOH溶液的体积比约为1:10;故答案为:1:10。
,则硫酸溶液和NaOH溶液的体积比约为1:10;故答案为:1:10。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 molL-1的碳酸钠溶液250 mL。
(1)根据计算需取___________克无水碳酸钠固体
(2)需要使用的主要仪器有托盘天平,____________、____________、_____________、____________和___________;
(3)下列操作对所配制溶液的浓度有何影响(填偏高、偏低或无影响)
①碳酸钠固体未充分干燥______________;
②容量瓶用碳酸钠溶液洗涤_____________;
③转移溶液时容量瓶中有少量的蒸馏水__________;
④定容时仰视读数_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是( )
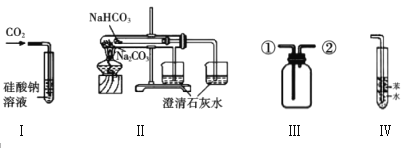
A.装置Ⅰ:可以用来验证硅酸和碳酸的酸性强弱
B.装置Ⅱ:可以用来比较![]() 和
和![]() 的热稳定性
的热稳定性
C.装置Ⅲ:从①口进气收集满二氧化碳,再从②口进气,可收集![]() 气体
气体
D.装置Ⅳ:可用于吸收![]() 气体,并防止倒吸
气体,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质的结构与性质)
钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)基态钛原子外围电子的轨道表达式为___________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有___种。
(2)金属钛的熔点、硬度均比铝大,可能的原因是____。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是__________ (填化学式)。

(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图所示。
①组成该物质的元素中,电负性最大的是__________ (填元素名称)。
②M中碳原子的杂化形式有___________种。
③M中不含__________ (填字母代号)。
a.π键 b.σ键 c.配位键
d.氢键 e.离子键

(5)①金属钛晶体中原子采用面心立方最密堆积,则晶胞中钛原子的配位数为_____。
②设钛原子的直径为d cm,用NA表示阿伏加德罗常数的值,钛原子的摩尔质量为M g·mol-1,则晶体钛的密度为________g·cm-3。
③金属钛晶胞中有若干个正四面体空隙,如图中a、b、c、d四个钛原子形成一个正四面体,其内部为正四面体空隙,可以填充其他原子。若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )

(注:铝土矿中含有![]() 、
、![]() 、
、![]() )
)
A.由铝土矿制备铝的过程中铝元素发生了氧化反应
B.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C.在制粗硅的反应中,氧化剂与还原剂的物质的量之比为1∶2
D.黄铜矿![]() 与
与![]() 反应产生的
反应产生的![]() 、
、![]() 均只是还原产物
均只是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O中含有的质子数为10NA
B. 60 g二氧化硅中含有的Si—O键数目为4NA
C. 密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2NA
D. 标准状况下,22.4 L氯气通入足量水中充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
A. 升高温度,![]() 增大,
增大,![]() 逆减小
逆减小
B. 平衡后再加入1molB,上述反应的ΔH增大
C. 通入稀有气体,压强增大,平衡向正反应方向移动
D. 若B的平衡转化率为50%,则该反应的平衡常数等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生话密切相关。下列说法错误的是
A. 生活中用到的陶瓷,如日用器皿、建筑饰材、卫生活具等主要是传统硅酸盐陶瓷
B. 铝制餐具不宜用来蒸煮或长时间存放酸性和碱性食物,但可长时间存放咸的食物
C. 洗发时使用的护发素主要是调节头发的![]() ,使之达到适宜的酸碱度
,使之达到适宜的酸碱度
D. 煤的干馏、海带提碘、石油裂解、芒硝风化等都涉及化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com