
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O中含有的质子数为10NA
B. 60 g二氧化硅中含有的Si—O键数目为4NA
C. 密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2NA
D. 标准状况下,22.4 L氯气通入足量水中充分反应后转移电子数为NA
【答案】B
【解析】
A.一个D2O分子中含有10个质子,D2O的摩尔质量为20g·mol-1,故18gD2O中含有的D2O分子数为0.9NA,其中含有的质子数为9NA,故A错误;
B.二氧化硅晶体中,每个硅原子和4个氧原子形成4个Si—O键,60 g二氧化硅中含有NA个硅原子,故含有的Si—O键的数目为4NA,故B正确;
C.2molNO与1molO2完全反应生成2molNO2,但体系中存在化学平衡2NO2![]() N2O4,所以产物的分子数小于2NA,故C错误;
N2O4,所以产物的分子数小于2NA,故C错误;
D.氯气与水能发生反应Cl2+H2O![]() HCl+HClO,标准状况下,22.4L(1mol)氯气与水完全反应转移的电子数应为NA,但此反应属于可逆反应,转移的电子数小于NA,故D错误。
HCl+HClO,标准状况下,22.4L(1mol)氯气与水完全反应转移的电子数应为NA,但此反应属于可逆反应,转移的电子数小于NA,故D错误。
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
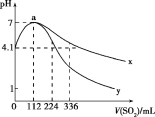
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至______。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为_________,由水电离出的c(OH-)=________mol·L-1。
(3)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中提纯Al2O3,并回收铁红。流程如下:
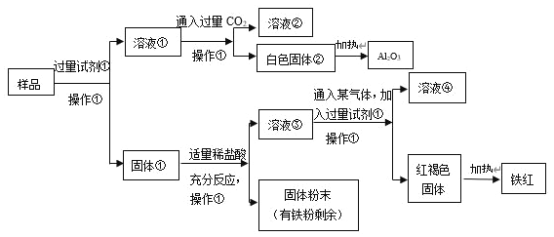
(1)操作①是_________,在实验室进行该操作需要的玻璃仪器有_________。
(2)白色固体②是_________,样品和试剂①反应的化学方程式是_________。
(3)固体①加入适量稀盐酸,可能发生的反应有:_______(用化学方程式表达)。
(4)溶液③中铁元素的存在形式是_________,如何用实验证明:____。
(5)溶液③中通入某气体,该气体可以是_________(任写一种的化学式),红褐色固体制得铁红的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是____。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为____,提供孤电子对的成键原子是______。
③氨的沸点__________(填“高于”或“低于”)膦(PH3),原因是_________;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由_______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________。
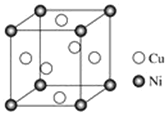
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为d g·cm–3,晶胞参数a=______nm。(用含有d、NA的式子表示,可以不化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是___(用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的____(填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
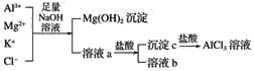
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:___,__,___。
②氢氧化钠溶液能否用氨水代替,为什么?___。
③溶液a中存在的离子有___,在溶液a中加入盐酸时需控制盐酸的量,为什么?___,为此,改进方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com