
【题目】下列各选项所述的两个量,前者一定大于后者的是 ( )
①Al原子和N原子的未成对电子数 ②Ag+、Cu2+与NH3形成配合物时的配位数 ③H—F的键能与H—I的键能 ④F元素和O元素的电负性 ⑤N和O元素的第一电离能
A. ①④⑤ B. ②④ C. ②④⑤ D. ③④⑤
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X与Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。
(1)写出下列元素符号:
X ,Y ,Z
(2)X与Y两元素可形成化合物属 (“离子”或“共价 ”)化合物。
(3)写出X与Z所形成的化合物的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:______________,反应类型:________。
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:______________________,反应类型:________。
III.已知乙烯能发生以下转化:

(1)C中含官能团名称_________;
(2)写出B与D反应的化学方程式_______________________;反应类型:________。
(3)写出反应③的化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2L的密闭容器中通入4.0mol的氮气和适量的氢气,发生反应:N2(g)+3H2(g) ![]() 2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内用氢气表示的反应速率为( )
2NH3(g)。经过5s后,测得氮气还剩余3.0mol,在这5s内用氢气表示的反应速率为( )
A. 0.3mol/(L·s) B. 0.6mol/(L·s) C. 0.1mol/(L·s) D. 0.2mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )
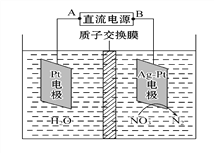
A. A为电源的正极
B. 溶液中H+从阳极向阴极迁移
C. 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2
D. Ag-Pt电极的电极反应式为2NO3-+12H++10e- = N2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中正确的是( )
A. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1
B. 已知CH3OH(g)+1/2O2(g) == CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1 ,则2H2O(g) == 2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g) == 3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com