
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水法收集
D.1.12 LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度。 实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g/mL)。按图组装好实验装置。
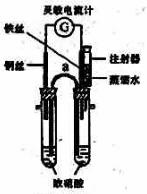 ②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向。在指针恰好发生反转又指向铜丝时停止实验,记录此时已注入的水的体积。
重复三次实验获得的数据如下:
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
请回答下列问题:
(1)在该装置中仪器a因其作用而称为 ;指针指向铁丝时,铁丝为 极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是 ;在未注水前正极的电极反应式为 。
(3)T1 T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为 %;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向 电极(填“铁”或“铜”)
(5)该实验装置上的不足是 ,改进方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
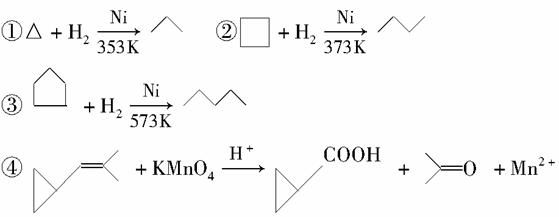
环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。

回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是__________(填名称)。判断依据为_____________________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为_________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法。试剂__________;现象与结论______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有如下各说法
①在水中氢、氧原子间均以化学键相结合。
②离子键是阳离子、阴离子的相互吸引。
③根据电离方程式 ,可判断HCl分子里存在离子键。
,可判断HCl分子里存在离子键。
④互为同素异形体的物质性质完全不同。
⑤分子组成相差一个或若干个“CH2”原子团的有机化合物互称为同系物
上述各种说法中正确的有几句( )
A.0句 B.1句 C.2句 D.3句
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)把6 mol A气体和5 mol B气体混合放入4 L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则①平衡时A的物质的量浓度是____________;B的转化率是__________。②在下面空白处用三段式写出求算x的过程。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则①平衡时A的物质的量浓度是____________;B的转化率是__________。②在下面空白处用三段式写出求算x的过程。
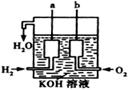
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:
a、b两个电极均由多孔的碳块组成。写出a极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为强电解质
④C60、C70、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉、水雾、纳米材料均为胶体
A.①③④ B.②③ C.②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.n(Na+)∶n(Cl-) 可能为7∶3
C.若反应中转移的电子为n mol,则n一定大于0.15 mol
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理、方法和结论都正确的是
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
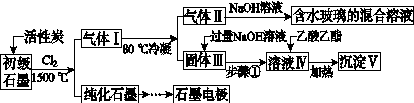
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com