
��15�֣�
ij��ѧ�о�С��ⶨijFeCl3��Ʒ��������FeCl2���ʣ�����Ԫ�ص�������������ʵ�����а����²������ʵ�飺
�ٳ�ȡa g��Ʒ�������ձ��У�
��ȡ�����������������ˮʹ��Ʒ�ܽ⣬ȷ���Ƴ�250mL��Һ��
��ȷ��ȡ25.00mL���������õ���Һ�������ձ��У�������������ˮ��ʹ��Ӧ��ȫ��
�ܼ��������ˮ����ֽ��裬ʹ������ȫ��
�ݹ��ˣ�ϴ�ӳ�����
������ת�Ƶ������ڣ����ȡ����裬ֱ�������ɺ��ɫȫ����Ϊ����ɫ����ȴ�����º�����
�ߡ���

���������������ش��������⣺
��1��װ��D�������� ����ͼ���������У�ʵ�鲽��٢ڢ��б����õ���������E��_______ ����������ţ���
��2�����������������Ӧ�����ӷ���ʽΪ ��
��3��������м�������Ƿ���ȫ�IJ�����
�������ϴ�ӳ����IJ����ǣ�________________________________
��4����������Ƿ�ϴ���IJ�����ȡ���һ��ϴ��Һ�����뼸��______ ����д��ţ���
��KSCN��Һ ��NaOH��Һ ��AgNO3��Һ �ܷ�̪��Һ
��5��������������W1 g�����������������������W2 g������Ʒ����Ԫ�ص���������Ϊ_______��
26����1����Һ©������2�֣���CFG��3�֣�
��2��2Fe2++Cl2 ��2Fe3++2Cl-����2�֣�
��3��ȡ�����ϲ���Һ���Թ��У����백ˮ�����������������ȫ����2�֣�
�ز����������������©�����еij����ϼ�����ˮ����û����������ʹ��ȫ���˳����ظ�����2��3�Σ�2�֣� ��4���ۣ�2�֣� ��5��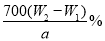 ��2�֣�
��2�֣�
��������
�����������1�� װ��D�������Ƿ�Һ©��������ٳ��������ܽ����ȡ�б����õ��������ձ����ζ��ܡ�������ƽ������ƿ������ͼ����������ʵ�鲽��٢ڢ��б����õ���������E��CFG����2��ijFeCl3��Ʒ��������FeCl2���ʣ������Һ������������ˮĿ���ǽ�+2����������+3�ۣ��������ӷ���ʽΪ2Fe2++Cl2 ��2Fe3++2Cl-����3��������м��������ˮ����ֽ��裬Ŀ����ʹFe3+������ȫ,��ˣ���������Ƿ���ȫ�IJ�����ȡ�����ϲ���Һ���Թ��У����백ˮ�����������������ȫ�����������ϴ�ӳ����IJ������ز����������������©�����еij����ϼ�����ˮ����û����������ʹ��ȫ���˳����ظ�����2��3�Σ�2�֣���4���������������ӣ�������������Һ���������ӣ��������������ϡ����İ�ɫ��������֤�����������ӣ�ѡ�ۣ���5����4��������������W1 g�����������������������W2 g����������������=��W2-W1��g����Ԫ�ص���������={[112/160]x(W2-W1)}:a��100%=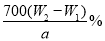
���㣺����̽�����ʵ���ɺͲ������ʵĺ�����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡ��У�����о��������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
����������AlON����һ������Ӳ�ȷ������ϣ������ɷ�ӦAl2O3+C+N2=2AlON+CO(����)�ϳɣ������й�˵����ȷ����
A�����������е��Ļ��ϼ���-3
B����Ӧ�е�����������
C����Ӧ��ÿ����5.7g AlON ͬʱ����1.12 L CO
D����Ӧ����������ͻ�ԭ��������ʵ���֮����2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��������ѧͬ����ʱ�����˽�ѡ��4��1.3��ѧ��Ӧ�ȵļ��㣨�����棩 ���ͣ�ѡ����
��֪3��6 g̼��6��4 g��������ȼ�գ�����Ӧ��ľ����ų�X kJ��������֪����̼ȼ���ȵĦ�HΪ-Y kJ�� mol-1����1 mol C��O2��Ӧ����CO�ķ�Ӧ�Ȧ�HΪ(����)
A��-(5X-0��5Y) kJ�� mol-1
B��-Y kJ�� mol-1
C��-(10X-Y) kJ�� mol-1
D��+(10X-Y) kJ�� mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£���Һ������Զ�TiO2���Ⱦ��R���ⷴӦ��Ӱ����ͼ��ʾ�������ж���ȷ����( )

A����0-50 min֮�䣬 pH = 2��PH = 7ʱR�Ľ���ٷ��ʲ����
B���� 20-25 min֮�䣬 pH = 10 ʱR��ƽ����������Ϊ0.04 mol?L-1?min-1
C����Һ����Խǿ�� R �Ľ�������ԽС
D��R����ʼŨ�Ⱥ���Һ��PH��Ӱ��R�Ľ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�ڵ�һ���¿������Ծ��������棩 ���ͣ������
����ѧ����ѡ��5���л���ѧ��������15�֣�
3?�Լױ���ϩ�����(E)��һ�����ںϳɿ�Ѫ˨ҩ���м��壬��ϳ�·�����£�

��֪��HCHO��CH3CHO CH2===CHCHO��H2O
CH2===CHCHO��H2O
��1����FeCl3��Һ����ɫ�ұ�����������ȡ������A��ͬ���칹����____________�֣�д������һ�ֵĽṹ��ʽ ��ij�л����A��һ����ԭ�ӣ����ж���ͬ���칹�壬�������ڷ��������� �֣�B�к��������ŵ�����Ϊ________��
��2���Լ�C��ѡ�������е�________��
a����ˮ b��������Һ
c������KMnO4��Һ d������Cu(OH)2����Һ
��3�� 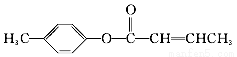 ��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ____________________��
��E��һ��ͬ���칹�壬������������NaOH��Һ���ȵĻ�ѧ����ʽΪ____________________��
��4��E��һ�������¿������ɸ߾���F��F�Ľṹ��ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�ڵ�һ���¿������Ծ��������棩 ���ͣ�ѡ����
����ʵ���ܴﵽĿ�ĵ���
A��ֻ�μӰ�ˮ����NaCl��AlCl3��MgCl2��Na2SO4������Һ
B����NH4Cl��Һ�����Ʊ�NH4Cl����
C������ȡ��Һ�ķ�����ȥ�ƾ��е�ˮ
D���ÿɼ�����������������Һ�ͽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ������ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����֢�����Ұ����������ڷ�������л��������һ���Ŵ�������ת����������
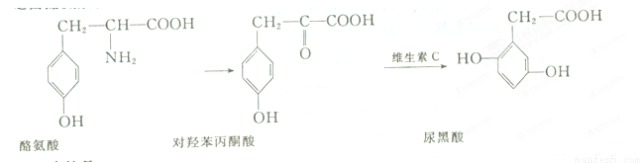
����˵������ȷ����
A���Ұ�����������ᷴӦ������NaOH��Һ��Ӧ
B�����DZ���ͪ���������3�ֺ���������
C��1 mol����������뺬3 mol NaOH����Һ��Ӧ
D��������ˮ������DZ���ͪ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ��и���������9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪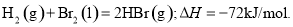 ����1mol Br2��l����Ҫ���յ�����Ϊ30kJ����������������±���
����1mol Br2��l����Ҫ���յ�����Ϊ30kJ����������������±���
| H2(g) | Br2(g) | HBr(g) |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | a | 369 |
�����aΪ
A��404 B��260 C��230 D��200
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ���2012������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�̲�������ͼʾ���ʶ�Ӧ����Ҫ�ɷִ������
| A | B | C | D |
���� |
|
|
|
|
��Ҫ �ɷ� | Fe2O3 | S | ������ | �� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com