
【题目】下列电子排布式不属基态的是( )
A.1s22s12p5
B.1s22s22p6
C.1s22s22p63 s2
D.1s22s22p63s1
科目:高中化学 来源: 题型:
【题目】下列各溶液中所含的Cl-与1molCaCl2溶液中Cl-数目相同的是
A.2molZnCl2B.1molKClC.1molMgCl2D.2molNaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较中,错误的是( )
A.半径:F﹣>Na+>Mg2+>A13+B.热稳定性:PH3>H2S>HCl
C.酸性:HClO4>H2SO4>H3PO4D.氧化性:F2>C12>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl﹣)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)═2c(HCO3﹣)+2c(H2CO3)+2c(CO ![]() )
)
D.pH=1的NaHSO4溶液:c(H+)═2c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存,且溶液呈无色的是
A. Na+、Mg2+、NO3-、CO32- B. K+、MnO4-、Cl-、SO42-
C. Ca2+、H+、ClO-、Cl- D. Na+、OH-、NO3-、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体如图所示与所述情形相符的是( )

A. 向HCl和AlCl3的混合液中滴加NaOH
B.向NaOH和Ca(OH)2的混合液中通入CO2
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NaOH和Na2CO3的混合液中滴加稀HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A.0.1(b﹣2a) molL﹣1
B.10(2a﹣b) molL﹣1
C.10(b﹣a) molL﹣1
D.10(b﹣2a) molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. ω=17c/(1 000ρ)
C. ω=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.制备水杨酸对正辛基苯基酯( ![]() )的过程如下:
)的过程如下:
步骤一:将水杨酸晶体投入到三颈烧瓶中,再加入适量的氯苯作溶剂并充分搅拌使晶体完全溶解,最后加入少量的无水三氯化铝。
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2 , 反应制得水杨酰氯。
该反应方程式为: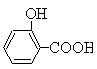 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ 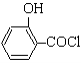 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑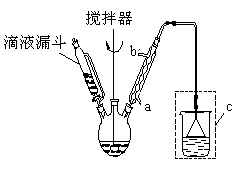
步骤三:将三颈烧瓶中混合液升温至80℃,再加入对正辛苯酚[ ![]() ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥即得产品。
(1)实验时,冷凝管中的冷却水进口为 (选填“a”或“b”);
(2)步骤一中加入无水三氯化铝的作用是 。
(3)步骤三中发生反应的化学方程式为 。
(4)Ⅱ.PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
白磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
已知下图是实验室制备PCl3的装置(部分仪器已省略),则: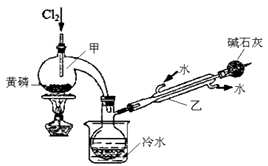
实验室制备Cl2的离子反应方程式为:。
(5)碱石灰的作用除了防止空气中的O2和水蒸气进入并与产品发生反应外还有:。
(6)向仪器甲中通入干燥Cl2之前,应先通入一段时间的干燥CO2 , 其目的是。
(7)测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应,则根据上述数据,求出该产品中PCl3的质量分数为 (用含字母的代数式表示、可不化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com