
 CO(g)+H2(g)达到平衡时,测得气体的总质量为m g,混合气体的物质的量为n mol。当改变条件使平衡向左移动达到新的平衡时,混合气体物质的量的变化值△n=x mol,且m>12x,n>x,请回答下列问题:
CO(g)+H2(g)达到平衡时,测得气体的总质量为m g,混合气体的物质的量为n mol。当改变条件使平衡向左移动达到新的平衡时,混合气体物质的量的变化值△n=x mol,且m>12x,n>x,请回答下列问题:  期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:阅读理解
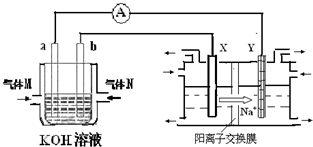 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
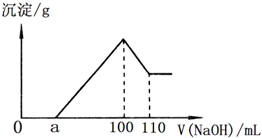 准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:
准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

(1)H2SO4溶液物质的量浓度为____________;
(2)若a=2.3,则用于沉淀Fe3+而消耗NaOH的体积是__________mL,铝土矿中各组成成分的质量分数:Al2O3为__________,Fe2O3为__________,SiO2为__________;
(3)a值的范围应是__________,在这个范围内,a值越大,__________的质量分数越小.
查看答案和解析>>
科目:高中化学 来源:2010年宁波市八校高二下学期期末联考化学试题 题型:实验题
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:

(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:

根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com