
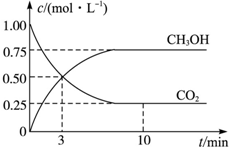
 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.分析 (1)由图可知,二氧化碳的浓度变化量为0.75mol/L,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol•(L•min)-1,结合速率之比等于化学计量数之比计算H2的平均反应速率;结合转化率=$\frac{转化的量}{开始的量}$×100%、反应不能完全转化分析;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
(3)结合平衡的特征“等、定”及衍生的物理量判断;
(4)能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,使平衡正向移动.
解答 解:(1)由图可知,二氧化碳的浓度变化量为0.75mol/L,v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol•(L•min)-1,由速率之比等于化学计量数之比可知H2的平均反应速率为0.075mol•(L•min)-1×3=0.225mol•(L•min)-1,CO2的平衡转化率为$\frac{0.75}{1}$×100%=75%,转化的二氧化碳小于1mol,则平衡时放出的热量小于49.0kJ,
故答案为:0.225;75%;小于;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的K=$\frac{c({C}_{3}HOH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 3 0 0
转化 0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×(0.75)^{3}}$=$\frac{16}{3}$,
故答案为:K=$\frac{c({C}_{3}HOH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;$\frac{16}{3}$;
(3)A.容器内压强不再变化,可知物质的量不变,为平衡状态,故A正确;
B.平均相对分子质量不再变化,物质的量不变,为平衡状态,故B正确;
C.c(CO2)和c(H2)之比等于1:3,不能判断是否平衡,与开始的量、转化率有关,故C错误;
D.相同时间内每断裂3mol H-H键,同时断裂3mol O-H键,可知正逆反应速率相同,故D正确;
故答案为:ABD;
(4)A.再充入1mol CO2和3mol H2,压强增大,平衡正向移动,则能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,故A正确;
B.将H2O(g)从体系中分离,平衡正向移动,能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$减小,故B正确;
C.充入氦气使体系压强增大,平衡不移动,$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$不变,故C错误;
D.该反应为放热反应,升高温度,平衡逆向移动,能使$\frac{n(C{O}_{2})}{n(C{H}_{3}OH)}$增大,故D错误;
故答案为:AB.
点评 本题考查化学平衡计算及图象,为高频考点,把握图中浓度变化、平衡判定、化学平衡常数K的计算为解答的关键,侧重分析与计算能力的考查,注意图象分析与应用,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C(SO3)=0.4mol•L-1 | B. | C(SO3)+C(SO2)=0.3 mol•L-1 | ||
| C. | C(O2)=0.3mol•L-1 | D. | C(SO3)=0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移动的原因可能是减压 | |
| C. | 若升高温度后的平衡常数的值为1.0,则该正反应为吸热反应 | |
| D. | 若起始时容器中SO3的物质的量改为1.0 mol,则平衡时n(SO2)=0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
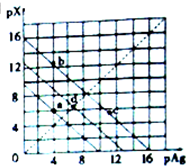 某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条沉淀溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),下列说法错误的是( )| A. | 由a点可知该温度下Ksp(AgCl)=l0-10 | |
| B. | 加入AgNO3可使溶液由b点变到c点 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | 坐标点(14,8)形成的溶液是AgI的不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
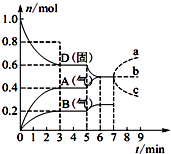 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列叙述不正确的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.066 7 mol/(L•min) | |
| B. | 该反应的化学方程式为2D(s)?2A(g)+B(g),该反应的平衡常数表达式为K=c2(A)•c(B) | |
| C. | 已知反应的△H>0,则第5 min时图象呈现上述变化的原因可能是升高体系的温度 | |
| D. | 若在第7 min时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com