
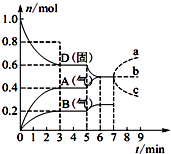
 ���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������
���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������| A�� | �ӷ�Ӧ��ʼ����һ�δﵽƽ��ʱ��A���ʵ�ƽ����Ӧ����Ϊ0.066 7 mol/��L•min�� | |
| B�� | �÷�Ӧ�Ļ�ѧ����ʽΪ2D��s��?2A��g��+B��g�����÷�Ӧ��ƽ�ⳣ������ʽΪK=c2��A��•c��B�� | |
| C�� | ��֪��Ӧ�ġ�H��0�����5 minʱͼ����������仯��ԭ�������������ϵ���¶� | |
| D�� | ���ڵ�7 minʱ����D�����ʵ��������ʾA�����ʵ����仯��ȷ����a���� |
���� A������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
B�����ݸ����ʱ仯�����жϷ�Ӧ����������ת����֮�ȵ��ڼ���ϵ��֮�ȼ��㷽��ʽ����ϵ����ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮����ֵ��ע����岻�ܴ������ʽ��
C����5����ʱA��B�����ʵ�����ԭ���Ļ��������ӣ���D�����ʵ�����ԭ���Ļ����ϼ�С��˵��ƽ�������ƶ������ڷ�Ӧ�ġ�H��0�����Դ�ʱ�������¶ȣ�
D���ı�����������ƽ�ⲻ�ƶ���
��� �⣺A������v=$\frac{��c}{��t}$�����A���ʵ�ƽ����Ӧ����Ϊ$\frac{\frac{0.4mol}{2L}}{3min}$=0.0667mol/��L•min������A��ȷ��
B������ͼ�ڵ�һ�δﵽƽ��ʱA�����ʵ���������0.4mol��B�����ʵ���������0.2mol������A��BΪ�����D�����ʵ���������0.4mol/L������DΪ��Ӧ�D��A��B�ı仯��֮��Ϊ0.4��0.4��0.2=2��2��1����Ӧ�и����ʼ�����֮�ȵ������ʵ�Ũ�ȵı仯��֮�ȣ�д����ѧ����ʽΪ2D��s��?2A��g��+B��g��������D�ǹ��壬����ƽ�ⳣ������ʽΪK=c2��A��•c��B������B��ȷ��
C����5����ʱA��B�����ʵ�����ԭ���Ļ��������ӣ���D�����ʵ�����ԭ���Ļ����ϼ�С��˵��ƽ�������ƶ������ڷ�Ӧ�ġ�H��0�����Դ�ʱ�������¶ȣ���C��ȷ��
D������D�ǹ��壬���ĸı䲻Ӱ�컯ѧƽ�⣬����A�����ʵ������䣬��D����
��ѡ��D��
���� ������Ҫ�����˻�ѧ��Ӧ���ʵļ��㡢����ͼд��ѧ����ʽ��ƽ�ⳣ���ı���ʽ��Ӱ�컯ѧƽ������ص�֪ʶ�㣬�е��Ѷȣ�����ʱҪע��DΪ�������ʣ�


 ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
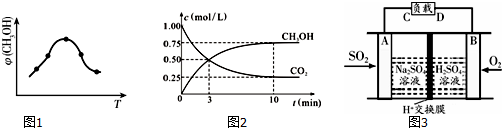
 ��ҵ�������CO2������ȼ�ϼ״����ȼ��ٶ�����̼���壬�ֵõ��������Դ���ʣ�Ϊ��̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2��ij�¶��·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����CO2��CH3OH��g����Ũ����ʱ��ı仯��ϵ��ͼ��ʾ��
��ҵ�������CO2������ȼ�ϼ״����ȼ��ٶ�����̼���壬�ֵõ��������Դ���ʣ�Ϊ��̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2��ij�¶��·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����CO2��CH3OH��g����Ũ����ʱ��ı仯��ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
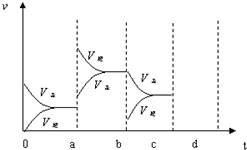 ��ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2?2SO3��H��0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a��b�����иı���������������£�b��c�����иı�����������Ǽ�С������ SO3 ��Ũ�ȣ� ������ѹǿʱ����Ӧ�ٶȱ仯�������c��d�������Ϸ�Ӧ��ƽ�������ʱֻ���������������Ϊԭ����2��������ƽ��ʱ���������¶Ƚ������������������Ƚ���������ߡ����͡���������ƽ��ʱ�������ڻ�������ƽ����Է���������ԭƽ��ʱ�����������С������ȡ��������Ϸ�Ӧ��ƽ�������ʱֻ���������������Ϊԭ����2��������ƽ��ʱ���������¶Ƚ������������������Ƚ���������ߡ����͡���������ƽ��ʱ�������ڻ�������ƽ����Է���������ԭƽ��ʱ�����������С������ȡ�����
��ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2?2SO3��H��0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a��b�����иı���������������£�b��c�����иı�����������Ǽ�С������ SO3 ��Ũ�ȣ� ������ѹǿʱ����Ӧ�ٶȱ仯�������c��d�������Ϸ�Ӧ��ƽ�������ʱֻ���������������Ϊԭ����2��������ƽ��ʱ���������¶Ƚ������������������Ƚ���������ߡ����͡���������ƽ��ʱ�������ڻ�������ƽ����Է���������ԭƽ��ʱ�����������С������ȡ��������Ϸ�Ӧ��ƽ�������ʱֻ���������������Ϊԭ����2��������ƽ��ʱ���������¶Ƚ������������������Ƚ���������ߡ����͡���������ƽ��ʱ�������ڻ�������ƽ����Է���������ԭƽ��ʱ�����������С������ȡ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 1 | 4 | 8 | 11 |
| n��H2��mol | 6 | 2.6 | 2 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���淴Ӧ�Ļ�ѧ����������a��b+c | |
| B�� | ѹ���������ݻ�ʱ��v������v����С | |
| C�� | �ﵽ��ƽ��ʱ��Y��ZŨ������Kֵ��� | |
| D�� | �ﵽ��ƽ��ʱ����������X��Ӧ������X��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪��HI��g���T$\frac{1}{2}$H2��g��+$\frac{1}{2}$I2��s����H=-26.5kJ/mol���ɴ˿�֪1mol HI�������ܱ������г�ַֽ����Էų�26.5kJ������ | |
| B�� | ��֪��2H2��g��+O2��g��=2H2O��l����H=-571.6 kJ/mol����������ȼ����Ϊ��H=-285.8 kJ/mol | |
| C�� | �£�N2H4����һ�����ڻ����ȼ�ϵ�ص�ԭ�ϣ���֪2H2O��g��+O2��g��=2H2O2��l����H=+108.3kJ/mol ��N2H4��l��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ/mol �����з�Ӧ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��l����H=-642.3kJ/mol | |
| D�� | ��20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH��aq��+CH3COOH��aq��=CH3COONa��aq��+H2O��l����H=-57.4 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com