
���� ��1������������Һ�������Сѡ����ʵ�����ƿ������ƿʹ��֮ǰҪ�Ȳ�©��
��2������n=cv��������CuSO4�����ʵ���������CuSO4•5H2O�����ʵ�������CuSO4�����ʵ���������m=nM����CuSO4•5H2O��CuSO4��������
��3�����ݵľ�������ǣ�������ƿ�м�������ˮ����Һ����̶���1��2cm��ʱ�����ý�ͷ�ιܼ�����ˮ����Һ����͵���̶������У�����ʱ��Һ�����ڿ̶��ߣ�
��� �⣺��1��������Һ�����Ϊ450mL��������ƿ�Ĺ��û��450mL��ֻ��ѡ��500mL����ƿ��������ʹ��ǰ�����Ƚ��в�©��
�ʴ�Ϊ��500����©��
��2�����ʵ����ʵ���n=cV=0.5L��0.2mol•L-1=0.1mol��CuSO4•5H2O�����ʵ�������CuSO4�����ʵ���������CuSO4•5H2O������0.1mol��250g/mol=25g��CuSO4������0.1mol��160g/mol=16g����������ķ������������룬
�ʴ�Ϊ��16.0g��25.0g���ң����룻
��3�����ݵľ�������ǣ�������ƿ�м�������ˮ����Һ����̶���1��2cm��ʱ�����ý�ͷ�ιܼ�����ˮ����Һ����͵���̶������У�����ʱ��Һ�����ڿ̶��ߣ����ݺ�Ҫҡ�ȣ��ʴ�Ϊ��1��2cm����ͷ�ιܣ�ҡ�ȣ��ף�
���� ���⿼����һ�����ʵ���Ũ����Һ�����ƣ��ѶȲ���ע��֪ʶ�����Ӧ���ǹؼ���


 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | Ũ�ȣ�mol/L�� | ʱ�䣨min�� | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | �� �� | 800�� | 1.0 | 0.80 | O��64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800�� | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��SO3��=0.4mol•L-1 | B�� | C��SO3��+C��SO2��=0.3 mol•L-1 | ||
| C�� | C��O2��=0.3mol•L-1 | D�� | C��SO3��=0.35 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������ϡ���3Fe2++4H++NO3-�T3Fe3++NO��+3H2O | |
| B�� | ��Na2SiO3��Һ��ͨ�����SO2��SiO32-+SO2+H2O�TH2SiO3��+SO32- | |
| C�� | NaHSO4��Һ��Ba��OH��2��Һ��Ӧ����SO42-��ȫ����ʱ��H++SO42-+OH-+Ba2+�TBaSO4��+H2O | |
| D�� | Na2S2O3��Һ�м���ϡ���2S2O32-+4H+�TSO42-+3S��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ˮ��Cl2+H2O�T2H++Cl-+ClO- | |
| B�� | NaHCO3�ĵ��뷽��ʽ��NaHCO3?Na++HCO3- | |
| C�� | Fe �����ᷴӦ�� H2��2Fe+6H+�T2Fe3++3H2�� | |
| D�� | NaHCO3��Һ�м�����Ba��OH��2��Һ��HCO3-+Ba2++OH-�TBaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڻ������Ǣڢߢ� | B�� | �����ε��Ǣޢ� | ||
| C�� | ���ڵ���ʵ��Ǣݢޢߢ� | D�� | ���ڷ�ɢϵ���Ǣڢߢ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
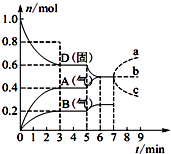 ���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������
���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������| A�� | �ӷ�Ӧ��ʼ����һ�δﵽƽ��ʱ��A���ʵ�ƽ����Ӧ����Ϊ0.066 7 mol/��L•min�� | |
| B�� | �÷�Ӧ�Ļ�ѧ����ʽΪ2D��s��?2A��g��+B��g�����÷�Ӧ��ƽ�ⳣ������ʽΪK=c2��A��•c��B�� | |
| C�� | ��֪��Ӧ�ġ�H��0�����5 minʱͼ����������仯��ԭ�������������ϵ���¶� | |
| D�� | ���ڵ�7 minʱ����D�����ʵ��������ʾA�����ʵ����仯��ȷ����a���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com