
þ����������������й㷺��;����ش��������⣺
(1)дþ��������Ӧ����ĵ���ʽ________��
(2)��ͼ�ǽ���þ��±�ط�Ӧ�������仯ͼ(��Ӧ��Ͳ����Ϊ298 Kʱ���ȶ�״̬)��������ѡ������ȷ����________��

A��MgI2��Mg2+��I�������������MgF2��Mg2+��F�����������
B��Mg��X2�ķ�Ӧ�Ƿ��ȷ�Ӧ
C��MgBr2��Cl2��Ӧ�Ħ�H��0
D������������ȶ���˳��ΪMgI2��MgBr2��MgCl2��MgF2
(3)��298 K��100 Kpaʱ����1 Lˮ�п��ܽ�0.09 mol������ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
�ٸ÷�Ӧ�����ӷ���ʽΪ________��ƽ�ⳣ������ʽΪ________
��������ƽ����ϵ�м�������NaCl���壬ƽ�⽫________(������ƶ������������ƶ����������ƶ���)������������ѹǿ���������ܽ�Ƚ�________��������ˮ��Ӧ��ƽ�ⳣ����________(��������С���������䡱)��
����֪��H2CO3![]() HCO3����H+Ka1(H2CO3)��4.45��10��7HCO3��
HCO3����H+Ka1(H2CO3)��4.45��10��7HCO3��![]() CO32����H+Ka2(H2CO3)��5.61��10��11HClO
CO32����H+Ka2(H2CO3)��5.61��10��11HClO![]() H+��ClO��Ka(HClO)��2.95��10��8
H+��ClO��Ka(HClO)��2.95��10��8
����������̼��ʹ�����ĵ���ƽ�ⳣ����д����������������������Ӧ�����ӷ���ʽ��������������ͨ�뵽������̼������Һ��________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ̨����ѧ�߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��16�֣�þ����������������й㷺��;����ش��������⣺
��1��дþ��������Ӧ����ĵ���ʽ
��2����ͼ�ǽ���þ��±�ط�Ӧ�������仯ͼ����Ӧ��Ͳ����Ϊ298Kʱ���ȶ�״̬����������ѡ������ȷ���� 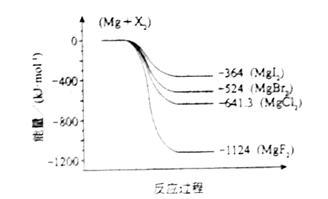
A MgI2��Mg2+��I-�����������MgF2��Mg2+��F-���������
B Mg��X2�ķ�Ӧ�Ƿ��ȷ�Ӧ
C MgBr2��Cl2��Ӧ�ġ�H��0
D ����������ȶ���˳��ΪMgI2��MgBr2��MgCl2��MgF2
��3����298K��100Kpaʱ����1Lˮ�п��ܽ�0.09mol������ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
�ٸ÷�Ӧ�����ӷ���ʽΪ ��ƽ�ⳣ������ʽΪ
��������ƽ����ϵ�м�������NaCl���壬ƽ�⽫ ��������ƶ������������ƶ����������ƶ�����������������ѹǿ���������ܽ�Ƚ� ��������ˮ��Ӧ��ƽ�ⳣ����
����������С���������䡱����
����֪�� H2CO3 HCO3�� + H+ Ka1(H2CO3) = 4.45��10��7
HCO3�� + H+ Ka1(H2CO3) = 4.45��10��7
HCO3�� CO32�� + H+ Ka2(H2CO3) = 5.61��10��11
CO32�� + H+ Ka2(H2CO3) = 5.61��10��11
HClO  H+ + ClO�� Ka(HClO) = 2.95��10��8
H+ + ClO�� Ka(HClO) = 2.95��10��8
����������̼��ʹ�����ĵ���ƽ�ⳣ����д����������������������Ӧ�����ӷ���ʽ��
������������ͨ�뵽������̼������Һ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��16�֣�þ����������������й㷺��;����ش��������⣺
��1��дþ��������Ӧ����ĵ���ʽ
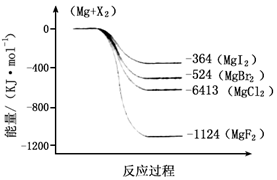
��2����ͼ�ǽ���þ��±�ط�Ӧ�������仯ͼ����Ӧ��Ͳ����Ϊ298Kʱ���ȶ�״̬����������ѡ������ȷ����
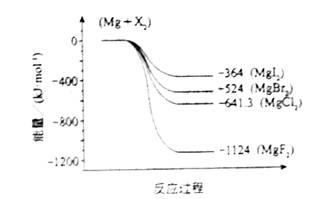
A MgI2��Mg2+��I-�����������MgF2��Mg2+��F-���������
B Mg��X2�ķ�Ӧ�Ƿ��ȷ�Ӧ
C MgBr2��Cl2��Ӧ�ġ�H��0
D ����������ȶ���˳��ΪMgI2��MgBr2��MgCl2��MgF2
��3����298K��100Kpaʱ����1Lˮ�п��ܽ�0.09mol������ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
�� �÷�Ӧ�����ӷ���ʽΪ ��ƽ�ⳣ������ʽΪ
��������ƽ����ϵ�м�������NaCl���壬ƽ�⽫ ��������ƶ������������ƶ����������ƶ�����������������ѹǿ���������ܽ�Ƚ� ��������ˮ��Ӧ��ƽ�ⳣ����
����������С���������䡱����
����֪��
H2CO3  HCO3�� + H+
Ka1(H2CO3) = 4.45��10��7
HCO3�� + H+
Ka1(H2CO3) = 4.45��10��7
HCO3�� CO32�� + H+
Ka2(H2CO3) = 5.61��10��11
CO32�� + H+
Ka2(H2CO3) = 5.61��10��11
HClO  H+ + ClO��
Ka(HClO) = 2.95��10��8
H+ + ClO��
Ka(HClO) = 2.95��10��8
����������̼��ʹ�����ĵ���ƽ�ⳣ����д����������������������Ӧ�����ӷ���ʽ��
������������ͨ�뵽������̼������Һ��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ʡ������ ���ͣ������
 HCO3�� + H+ Ka1(H2CO3) = 4.45��10��7
HCO3�� + H+ Ka1(H2CO3) = 4.45��10��7  CO32�� + H+ Ka2(H2CO3) = 5.61��10��11
CO32�� + H+ Ka2(H2CO3) = 5.61��10��11  H+ + ClO�� Ka(HClO) = 2.95��10��8
H+ + ClO�� Ka(HClO) = 2.95��10��8 �鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com