
(16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式
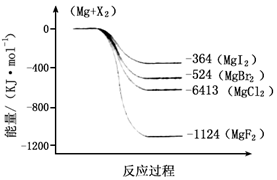
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是
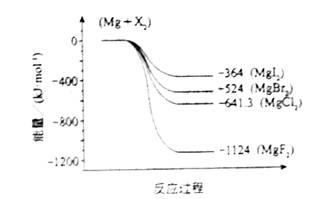
A MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B Mg与X2的反应是放热反应
C MgBr2与Cl2反应的△H<0
D 化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
① 该反应的离子方程式为 ,平衡常数表达式为
②在上述平衡体系中加入少量NaCl固体,平衡将 (填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将 ,氯气和水反应的平衡常数将
(填“变大”、“变小”、“不变”)。
③已知:
H2CO3  HCO3- + H+
Ka1(H2CO3) = 4.45×10-7
HCO3- + H+
Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+
Ka2(H2CO3) = 5.61×10-11
CO32- + H+
Ka2(H2CO3) = 5.61×10-11
HClO  H+ + ClO-
Ka(HClO) = 2.95×10-8
H+ + ClO-
Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(1) 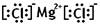 (2)
ABC
(2)
ABC
(3)① Cl2+H2O 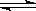 H++Cl-+HClO
, K=
H++Cl-+HClO
, K= 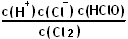
② 逆向移动 变大 不变 ③ Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO- (每空2分)
【解析】(1)氯化镁是由离子键形成的离子化合物,电子式为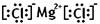 。
。
(2)根据反应过程中的能量变化可知,生成MgF2是放热最多,说明形成的离子键最强,化合物最稳定,所以只有选项D是错误的,答案选ABC。
(3)氯气溶于水生成盐酸和次氯酸,方程式为Cl2+H2O 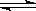 H++Cl-+HclO。所以平衡常数的表达式是
H++Cl-+HclO。所以平衡常数的表达式是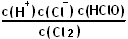 。如果加入氯化钠固体,则氯离子浓度增大,平衡向逆反应方向移动。压强越大,气体的溶解度越,但平衡常数只和温度有关系,所以平衡常数是不变的。根据平衡常数可知,碳酸的酸性强于次氯酸的,次氯酸的酸性强于碳酸氢钠的,所以根据较强的酸制取较弱的酸的原理可知,反应的方程式为Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-。
。如果加入氯化钠固体,则氯离子浓度增大,平衡向逆反应方向移动。压强越大,气体的溶解度越,但平衡常数只和温度有关系,所以平衡常数是不变的。根据平衡常数可知,碳酸的酸性强于次氯酸的,次氯酸的酸性强于碳酸氢钠的,所以根据较强的酸制取较弱的酸的原理可知,反应的方程式为Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:浙江省台州中学2011-2012学年高二下学期期中考试化学试题 题型:058
镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式________.
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态).则下列选项中正确的是________.

A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.MgBr2与Cl2反应的ΔH<0
D.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298 K、100 Kpa时,在1 L水中可溶解0.09 mol氯气,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
①该反应的离子方程式为________,平衡常数表达式为________
②在上述平衡体系中加入少量NaCl固体,平衡将________(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将________,氯气和水反应的平衡常数将________(填“变大”、“变小”、“不变”).
③已知:H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7HCO3-
HCO3-+H+Ka1(H2CO3)=4.45×10-7HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11HClO
CO32-+H+Ka2(H2CO3)=5.61×10-11HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:将少量的氯气通入到过量的碳酸钠溶液中________;
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(16分)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 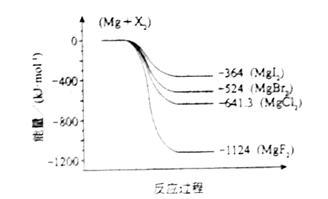
A MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B Mg与X2的反应是放热反应
C MgBr2与Cl2反应的△H<0
D 化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298K、100Kpa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
①该反应的离子方程式为 ,平衡常数表达式为
②在上述平衡体系中加入少量NaCl固体,平衡将 (填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将 ,氯气和水反应的平衡常数将
(填“变大”、“变小”、“不变”)。
③已知: H2CO3 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
HClO  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
查看答案和解析>>
科目:高中化学 来源:浙江省期中题 题型:填空题
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7  CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11  H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com