
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验台上有序摆放整齐的药品中,有一瓶标签破损的试剂(见图).这瓶标签破损的溶液最有可能是( )
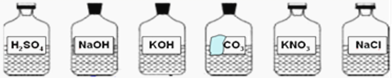
A.Na2CO3B.H2CO3C.BaCO3D.CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值。下列叙述正确的是
表示阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A.1mol的碳烯![]() :
:![]() 含电子数为6
含电子数为6![]()
B.一定温度下,15g甲醛和乙酸的混合物含O原子数为![]()
![]()
C.常温常压下,![]() g乙醇中含有
g乙醇中含有![]() 键的个数为
键的个数为![]()
![]()
D.标准状况下,![]() L庚烷完全燃烧后生成的
L庚烷完全燃烧后生成的![]() 分子数为
分子数为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是( )
A.标准状况下,22.4LCl2中所含的原子数为2NA
B.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数目为0.5NA
C.0.5mol·L-1NaCl溶液中所含的氯离子数目为0.5NA
D.常温下,28g氮气中所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
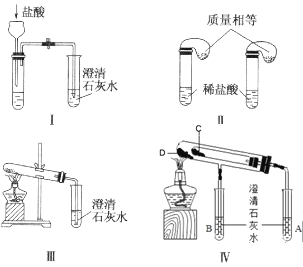
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.向氯化铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2-+ 2H2O
C.碳酸氢铵溶液中加足量的氢氧化钠溶液:NH4+ + OH- = NH3↑ + H2O
D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。

①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25°C时有关弱酸的电离平衡常数如下表:
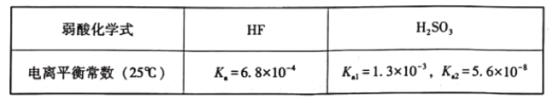
下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3)
B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com