
【题目】用![]() 表示阿伏加德罗常数的值。下列叙述正确的是
表示阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A.1mol的碳烯![]() :
:![]() 含电子数为6
含电子数为6![]()
B.一定温度下,15g甲醛和乙酸的混合物含O原子数为![]()
![]()
C.常温常压下,![]() g乙醇中含有
g乙醇中含有![]() 键的个数为
键的个数为![]()
![]()
D.标准状况下,![]() L庚烷完全燃烧后生成的
L庚烷完全燃烧后生成的![]() 分子数为
分子数为![]()
![]()
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。

下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 代表阿伏加德罗常数的数值,下列说法正确的是
A. 2.4 g 金属镁变成镁离子时失去的电子数目为 0.1NA
B. 18 g 水中含有 0.1NA 个水分子
C. 22.4 L 氮气所含的电子数目为 NA
D. 17 g 氨气所含电子数目为 10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25 g·Lˉ1。有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:

(1)C中所含官能团名称是____。
(2)写出反应④的化学方程式____。
(3)C与D在一定条件下可发生加成反应,生成具有酸性的物质F。F的结构简式为___。
(4)下列说法正确的是____。(填编号)
A.有机物E与F互为同分异构体
B.用新制氢氧化铜悬浊液无法区分有机物B和C
C.有机物A、D均能被酸性高锰酸钾溶液氧化
D.可用饱和NaOH溶液除去有机物E中混有的少量B、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据如下:
化合物 | 密度/gcm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
I.乙酸正丁酯粗产品的制备
在干燥的A中,装入沸石,加入11.5mL正丁醇和9.4mL冰酷酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)。温度计及回流冷凝管,热冷凝回流反应。
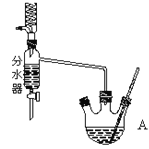
(1)实验过程中可能产生多种有机副产物。写出其中两种的结构简式:_________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:_________。
II.乙酸正丁酯粗产品的制备
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗,②蒸馏,③用无水MgSO4干燥,④用10%碳酸钠洗涤,正确的操作步骤是_________。
a ①②③④ b ③①④② c ①④①③② d ④①③②③
(4)将酯层采用下图所示装置蒸馏,图中仪器B的名称___________。冷却水从______口进入(填字母),蒸馏收集乙酸正丁酯产品时,应将温度控制在_________左右。
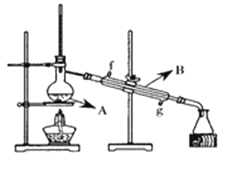
III.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M和乙炔可合成![]() 羟基丁酸,
羟基丁酸,![]() 羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。

已知:(1).
(2)![]()
(3)
(4)C的结构中不含有甲基
![]() A的结构简式为______,B的分子式______。
A的结构简式为______,B的分子式______。
![]() 反应
反应![]() 的反应类型______。
的反应类型______。
![]() 写出反应
写出反应![]() 化学方程式______。
化学方程式______。
![]() 某烃S是
某烃S是 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
![]() 理论上A也可以由1,
理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为______。
丁二烯与烃F来合成,则F的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
B.Ba(OH)2和H2SO4溶液 混合:Ba2++ SO42- == Ba SO4↓
C.往 NH4HCO3 溶液中加过量的 NaOH 溶液并加热:NH4+OHˉ===NH3↑+H2O
D.向硅酸钠溶液中通入过量的CO2:SiO32-+2CO2 + 2H2O == H2SiO3↓+2HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com