
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V (逆)增大,V(正)减小,平衡逆向移动 |
分析 依据化学平衡三段式列式计算;
2A(g)+B(g)═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A.依据反应速率v=$\frac{\frac{△n}{V}}{△t}$计算用C表示该反应的速率;
B.反应是可逆反应,不能进行彻底;
C.若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡;
D.升高温度正逆反应均增大.
解答 解:依据化学平衡三段式列式计算;
2A(g)+B(g)═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A.C的反应速率v(C)=$\frac{\frac{1.8mol}{2L}}{60s}$=0.015mol/(L•min),故A错误;
B.反应是可逆反应,不能进行彻底,达到平衡时测得放出热量为x kJ,则x<Q,故B错误;
C.若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡,所以A的体积分数保持不变,故C正确;
D.升高温度正逆反应均增大,即V(逆)、V(正)增大,平衡逆向移动,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,注意反应前后气体体积的变化,掌握基础和平衡移动原理是关键,还要把握三段式在化学平衡计算中的应用方法,试题培养了学生的灵活应用能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
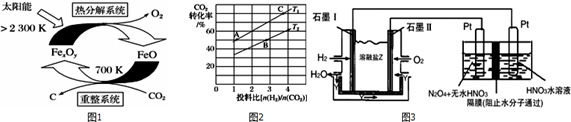
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶电解质,Ksp小的溶解度一定小 | |
| B. | 0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | 在硫酸钡的沉淀溶解平衡体系中加入蒸馏水,硫酸钡的Ksp增大 | |
| D. | 用锌片作阳极,铁片作阴极,电解ZnCl2溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:
Ca(H2PO2)2(次磷酸钙,一元中强酸H3PO2的钙盐)是一种白色结晶粉末,溶于水(常温时,溶解度16.7g/100g水),其水溶液呈现弱酸性.可用作医药、抗氧化剂以及制备次磷酸钠等.由白磷(P4)与石灰乳制备Ca(H2PO2)2的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3的电离方程式:NaHCO3?Na++HCO3- | |
| C. | Fe 与盐酸反应制 H2:2Fe+6H+═2Fe3++3H2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com