
下列说法正确的是
A.短周期元素形成离子后,最外层均达8电子稳定结构
B.多电子原子中,在离核较近的区域运动的电子能量较低
C.非金属元素组成的化合物中只有共价键
D.HF、HCl、HBr、HI的热稳定性和还原性依次增强
科目:高中化学 来源:2014高考名师推荐化学STS应用(解析版) 题型:选择题
下列说法正确的是
A.医用酒精、冰醋酸、液态HCl都是混合物
B.水晶、玛瑙和刚玉的主要成分都是二氧化硅
C.淀粉、油脂和蛋白质都能发生水解反应
D.铁遇到冷的浓硝酸和稀硝酸均会钝化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:实验题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 氧化Fe2+的离子方程式补充完整:
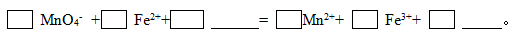
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的 。
(4)己知:一定条件下,MnO4- 可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 。
②Ⅳ中加入MnSO4的目的是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
下列实验操作、现象和解释都正确的是
选项 | 实验操作 | 现象 | 解释 |
A | 在密闭容器中加热CuO | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)

请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列分类正确的是
A.共价化合物:硫酸、水、纯碱
B. 非电解质:乙醇、二氧化碳、氨气
C. 胶体:饱和氯化铁溶液、豆浆、牛奶
D.硅酸盐产品:水晶、玻璃、陶瓷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。

①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
已检测出pH=1的某未知溶液中含有Al3+和 ,若检验此溶液中是否大量存在以下6种离子:①ClO- ②
,若检验此溶液中是否大量存在以下6种离子:①ClO- ② ③Fe2+④K+ ⑤
③Fe2+④K+ ⑤ ⑥Cl-,其中不必检验就能加以否定的离子是
⑥Cl-,其中不必检验就能加以否定的离子是
A.①②⑥
B.②③④
C.①③⑤
D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是

A.通电后,可观察到清晰界面缓缓向上移动的原因是Cd2+向Pt电极迁移的结果
B.装置中Pt电极附近的pH增大
C.一定时间内,如果通过HCl溶液某一界面的总电量为5.0 C,测得H+所迁移的电量为4.1 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍
D.如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com