
【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)

请回答下列问题:
(1)流程中所涉及的化学工业 (写出两个即可)。
(2)反应I需在500℃进行,主要原因是 ;实际工业生产中,反应Ⅱ的条件是 。
(3)写出反应III的化学方程式 。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是 。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。
(1)合成氨,氨氧化法制硝酸,联合制碱法(或侯氏制减法)
(2)500℃时,该反应的催化剂的活性最高;铂铑合金作催化剂,高温
(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(4)增大NH4+和Cl-的浓度,析出副产品NH4Cl
(5)2NO2+Na2CO3=NaNO3+NaNO2+CO2
【解析】依据流程分析液态空气蒸馏得到氧气和氮气,焦炭和水蒸气反应生成氢气和一氧化碳;推断反应Ⅰ是合成氨的反应,所以A为O2、B为N2、C为H2、E为NH3,反应Ⅱ是氨气的催化氧化反应生成G为NO,H为NO2、I为HNO3,L为NH4NO3,D为CO,F为CO2;E+F+饱和食盐水=NaHCO3↓+NH4Cl,Ⅲ反应是工业侯德榜制碱法;K为NaHCO3,M为Na2CO3;J为NH4Cl;
(1)流程分析推断反应Ⅰ是工业合成氨;Ⅱ是工业上制硝酸的第一步氨气的催化氧化;Ⅲ是工业上候氏制碱法或联合制碱法;
(2)反应I合成氨是放热反应,需在500℃进行是为了提高反应速率,催化剂活性最大;实际工业生产中,反应Ⅱ的条件是铂铑合金做催化剂高温加热进行氨气的催化氧化反应;
(3)反应Ⅲ是候氏制碱法的反应原理,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)工业上,析出NaHCO3后,再向母液中继续通入NH3,并加入细小食盐颗料,是为了增大铵根离子和氯离子浓度,降低氯化铵的溶解度利于晶体析出;
(5)根据信息产物知,反应方程式是2NO2+Na2CO3=NaNO3+NaNO2+CO2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学STS应用(解析版) 题型:填空题
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
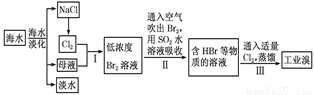
(1)请列举海水淡化的两种方法:________、________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是____________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
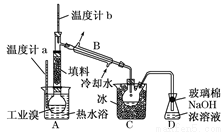
请你参与分析讨论:
①图中仪器B的名称:________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:____。
④C中液体产物颜色为________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
如图是某溶液在稀释过程中溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于
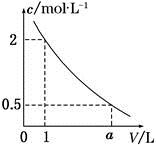
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)几种
A.15 B.16 C.17 D.18
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
氯碱工业常利用阳离子交换膜电解食盐水,下列说法不正确的是
A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水
B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量
C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集
D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列说法正确的是
A.短周期元素形成离子后,最外层均达8电子稳定结构
B.多电子原子中,在离核较近的区域运动的电子能量较低
C.非金属元素组成的化合物中只有共价键
D.HF、HCl、HBr、HI的热稳定性和还原性依次增强
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
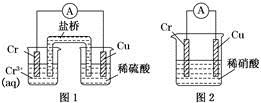
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
下列说法中不正确的是
A.光导纤维、硝化纤维、铜氨纤维、玻璃纤维的主成分都是糖类
B.生理盐水、葡萄糖注射液都不能产生丁达尔效应现象,不属于胶体
C.红外光谱仪可用于测定化合物的官能团、1H核磁共振仪可确定H所处的化学环境
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com