
【题目】将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液pH的变化是
A. 前者减小后者不变B. 前者减小后者增大C. 都不变D. 都减小
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,关于该反应说法正确的是
2Na2FeO4+Na2O,关于该反应说法正确的是
A. Fe2O3可以通过铁丝在氧气中燃烧制得
B. 反应中Na2O2是氧化剂
C. 生成1 mol Na2FeO4,有6 mol电子转移
D. 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌,又能在处理水时产生胶体净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业发展和社会进步,人们日益关注环境污染问题.下列措施有助于环境保护的是( )
A. 直接排放电镀废水入海B. 使用无磷洗衣粉
C. 大量使用含硫量高的燃煤D. 实施沙漠绿化工程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅气体产物的成分进行探究。
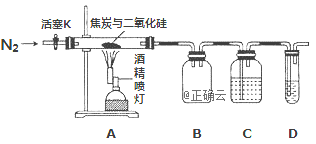
已知:PdCl2溶液可用于检验CO,反应的化学方程式为: CO+PdCl2 + H2O = CO2 +2HCl + Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________
(2)装置B的作用是________
(3)装置C中所盛试剂应为___________
(4)该装置的缺点是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示,据此,将甲和乙互相分离的方法是( )
物质 | 熔点(℃) | 沸点(℃) | 密度(gcm-3) | 水中溶解度 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 77 | 0.90 | 可溶 |
A.蒸馏法B.升华法C.萃取法D.过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-![]() H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在任何条件下都能实现
D. 自发反应在恰当条件下才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com