
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
【答案】 第三周期,ⅦA族 ac Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol 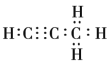 Mg2C3+4H2O=2Mg(OH)2+C3H4↑
Mg2C3+4H2O=2Mg(OH)2+C3H4↑
【解析】(1)根据图表可知,Z是17号氯元素,位于周期表的第三周期,ⅦA族;正确答案:第三周期,ⅦA族。
(2)由元素周期律,非金属元素的单质与氢气越容易化合,氢化物越稳定,非金属性越强,而得电子的数目多少不能作为比较非金属性强弱的依据;活泼的非金属单质能够置换不活泼的非金属单质,可以比较非金属的强弱;氯气可以置换硫,氯化氢比硫化氢稳定,正确选项为ac。
(3)X为硅元素,Z为氯元素,两元素的单质反应生成四氯化硅;已知该化合物的熔、沸点分别为-69℃和58℃,所以四氯化硅为液态,该反应的热化学方程式为:Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol ;正确答案:Si(s)+2C12(g)=SiCl4(1) △H=-687kJ/mol。
(4)设该烃分子式为CXHY,烃分子中碳氢质量比为9:1,即12x:y=9:1, x:y=3:4;即分子式为C3H4,该物质为丙炔,电子式为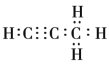 ;正确答案:
;正确答案: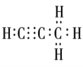 。
。
(5)根据1mol碳与镁形成的化合物Q与4mol水反应,生成2molMg(OH)2和1mol烃条件,遵循原子守恒规律,可知化合物Q的化学式为Mg2C3,反应的方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑;正确答案:Mg2C3+4H2O=2Mg(OH)2+C3H4↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为_______________________。
(2)1 mol HCHO分子中含有σ键的数目为________。
(3)HOCH2CN的结构简式 ,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
(4)与H2O分子互为等电子体的阴离子为________。
(5)下列一组微粒中键角由大到小顺序排列为_________________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) ![]() CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) △H=___________________。
CH3CH2OH(g)+3H2O(l) △H=___________________。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________极(填“正”或“负”)。F电极上的电极反应式为___________。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镍镧合金具有很强的储氢能力。
(1)用价层电子对互斥理论推测三氟化硼分子的立体构型为______,硼原子的杂化类型为_____。
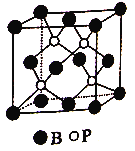
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞示意图,已知该晶胞的棱长为516pm,最近的B和P原子之间的距离为____pm。该晶体的晶体类型是________。
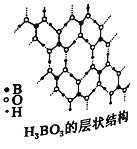
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如上图)。
①1molH3BO3的晶体中有_____mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则硼酸为_______元酸,[B(OH)4]-含有的化学键类型为_______。
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构,其中铜钙合金的结构单元如图所示。试回答下列问题:
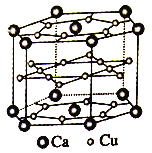
①在元素周期表中Ca位于______区。
②铜原子的基态原子核外电子排布式__________。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=_____(填数值);氢在合金中的密度为_____(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L 稀硫酸。
(1)所需浓硫酸的体积是__________。
(2)配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、________、_________。
(3)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为 ______(填序号)。
(4)第⑦步实验的操作是__________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.“偏大” b.“偏小” c.“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中_______;
B.容量瓶用蒸馏洗涤后残留有少量的水_________;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_________;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,设计如下实验:
①将2.3g该有机物完全燃烧,测得生成0.1molCO2和2.7g 水;
②用质谱仪测定其相对分子质量,得到如图所示的质谱图;
③用核磁共振仪处理该化合物,得到如下图所示核磁共振氢谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:


(1)有机物A的相对分子质量是____。
(2)有机物A的实验式是____。
(3)____(填“能”或“不能”)根据A的实验式确实A的分子式,若能,说明原因___。
(4)某有机化合物A在足量的氧气中完全燃烧只生成CO2和H2O,同温同压下,其蒸气对氢气的相对密度为37。用元素分析仪分析得知,A分子中含碳、氢的质量分数分别为64.9%和13.5%,则A的分子式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com