
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为_______________________。
(2)1 mol HCHO分子中含有σ键的数目为________。
(3)HOCH2CN的结构简式 ,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
(4)与H2O分子互为等电子体的阴离子为________。
(5)下列一组微粒中键角由大到小顺序排列为_________________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④CO32- ⑤H3O+
【答案】 1s22s22p63s23p63d10{或[Ar]3d10} 3NA sp3 sp NH![]() ①④②⑤③
①④②⑤③
【解析】(1)Zn是30号元素,其原子核外有30个电子,失去最外层两个电子生成锌离子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 ,故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键,HCHO分子中含有2个C-H键、1个C=O双键,分子中含有3个σ键,所以1mol甲醛(HCHO)分子中含有的σ键数目为3mol或3NA,故答案为:3 mol或3NA;
(3)HOCH2CN的结构简式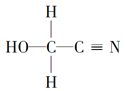 ,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对=2+
,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对=2+![]() =2,所以碳原子杂化轨道类型为sp,故答案为:sp3杂化、sp杂化;
=2,所以碳原子杂化轨道类型为sp,故答案为:sp3杂化、sp杂化;
(4)原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒该是3原子最外层电子数为8的分子或离子,这样的微粒有:H2S、NH2-,阴离子为:NH2-,故答案为:NH2-;
(5)①CO2是直线结构,键角为180°;②SiF4为正四面体结构,键角为109°28′;③SCl2中S采用sp3杂化,为V形结构;④CO32-中C采用sp2杂化,为正三角形结构,键角为120°;⑤H3O+中O采用sp3杂化,为三角锥形结构,③中2个孤电子对之间的斥力较大,使得③中键角小于⑤,同理⑤中键角小于②,因此键角由大到小顺序排列为①④②⑤③,故答案为:①④②⑤③。


科目:高中化学 来源: 题型:
【题目】人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质。该反应分两步进行:第一步:NaNO2+NH4Cl===NaCl+NH4NO2 第二步:NH4NO2![]() N2↑+2H2O,下列叙述中正确的是
N2↑+2H2O,下列叙述中正确的是
①两步反应中N元素都被氧化 ②NH4Cl在反应中充当还原剂
③NaNO2在反应中充当氧化剂 ④第二步中只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)键线式![]() 表示的有机物名称为__________。
表示的有机物名称为__________。
(2)A和B两种有机物可以互溶,其有关性质如表所示:
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7137 g/mL | -116.6 | 34.5 | 不溶于水 |
B | 0.7893 g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
要除去B中混有的少量A,可采用_________方法。
A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液
Ⅱ.(1)扁桃酸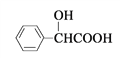 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
(2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______
III.有下列各组物质:
(A)S2和S4
(B) ![]() 和
和![]()
(C)CH4和C8H18
(D) 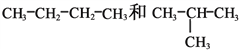
(E)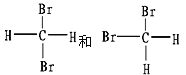
①_________组两物质互为同素异形体;
②_________组两物质互为同系物
IV.配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。
KClO3+______H2C2O4+H2SO4![]() _____ClO2↑+K2SO4+CO2↑+H2O
_____ClO2↑+K2SO4+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为( NH4)2SO4。
实验测得NH4HSO3溶液中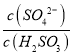 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(s) ![]() COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为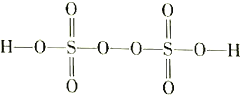 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
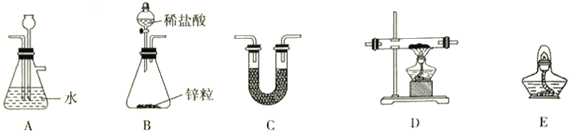
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
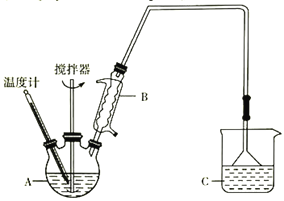
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com