
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为( NH4)2SO4。
实验测得NH4HSO3溶液中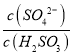 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(s) ![]() COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为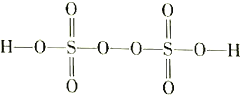 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
【答案】 CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1 6 bc 4 66.7% 0.4 2SO42--2e-=S2O82-
【解析】(1)①(b-c)/2+a CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1
CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1。
②Ka1=(C(H+).C(HSO3-))/C(H2SO3) Ka2=( C(H+). C(SO32-)/ C(HSO3- Ka1Ka2= C2(H+).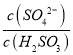 =1.5×10-2×1.0×10-7 C(H+)=1×10-6 溶液的pH为6。
=1.5×10-2×1.0×10-7 C(H+)=1×10-6 溶液的pH为6。
(2)COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。①恒温恒容条件下,密闭容器中发生上述反应,a.COS的浓度保持不变 说明化学反应达到平衡状态了; b.化学平衡常数只和温度有关,不受浓度影响,所以不能作为判断平衡的依据; c.混合气体的密度=m/V, 恒容V定值,都是气体所以m不变。故c不能;d.形成2molH-S键的同时形成1mol H-H键说明正逆反应速率相等,故可以作为判断平衡的标志。答案:b c。
H2S (g)+CO(g) ΔH>0。①恒温恒容条件下,密闭容器中发生上述反应,a.COS的浓度保持不变 说明化学反应达到平衡状态了; b.化学平衡常数只和温度有关,不受浓度影响,所以不能作为判断平衡的依据; c.混合气体的密度=m/V, 恒容V定值,都是气体所以m不变。故c不能;d.形成2molH-S键的同时形成1mol H-H键说明正逆反应速率相等,故可以作为判断平衡的标志。答案:b c。
②T1℃时H2S(g)+ CO(s) ![]() COS(g)+H2(g)K=(C(COS).C(H2))/C(H2S)= 0 25
COS(g)+H2(g)K=(C(COS).C(H2))/C(H2S)= 0 25
,COS(g)+H2(g)=H2S(g)+ CO(s) K= C(H2S)/ (C(COS).C(H2))=1/0 25=4
T1℃时,COS(g) + H2(g) = H2S(g)+ CO(s)
初始量 0.1 0.1 0 0
变化量 X X X X
平衡量 0.1-X 0.1-X X X
(3)K=X/(0.1-X)2=4 X=0.0667 COS的转化率为0.0667/0.1×100%= 66.7% ,答案:66.7%
① 5S2O82-+ 2Mn2+ +8H2O= 10SO42-+2MnO4-+16H+,
5mol 2mol
1mol X X=0.4mol
②用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。根据氧化还原原理知SO42-失电子做阳极,阳极的电极反应式为2SO42--2e-=S2O82-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料, 氯气极其相关产品在生产生活中应用广泛。结合氯气的相关知识解决下列问题;
(1)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是______________________;漂白粉的有效成分是(填化学式)_________。漂白粉在空气中长期存放会变质而失效的原理是(用化学方程式说明) _____________。
(2)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
MnCl2+Cl2↑+2H2O 由于氯气有毒所以实验室通常用___________________溶液吸收尾气(填化学式),反应的化学方程式为_____________________。
(3)氯气是一种常用的消毒剂,新制氯水含多种微粒并表现出不同的性质(用化学式或离子符号填写):
使氯水呈黄绿色的是________;能使AgNO3溶液产生白色沉淀的是________;能使紫色石蕊试液显红色的是________;能使红纸褪色的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为_______________________。
(2)1 mol HCHO分子中含有σ键的数目为________。
(3)HOCH2CN的结构简式 ,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
(4)与H2O分子互为等电子体的阴离子为________。
(5)下列一组微粒中键角由大到小顺序排列为_________________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2的燃烧热为286 kJ/mol,Li的燃烧热为299 kJ/mol。LiH可做飞船燃料,合成LiH的热化学方程式是2Li(s)+H2(g)=2LiH(s)△H=-182kJ/mol,则LiH的燃烧热为( )
A. 702 kJ/mol B. 442 kJ/mol C. 585 kJ/mol D. 351 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) ![]() CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) △H=___________________。
CH3CH2OH(g)+3H2O(l) △H=___________________。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________极(填“正”或“负”)。F电极上的电极反应式为___________。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com