
【题目】加热HCOONa固体,发生的反应有:2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3 +H2↑+CO↑ ②
Na2CO3 +H2↑+CO↑ ②
Na2C2O4 ![]() Na2CO3 + CO ↑ ③
Na2CO3 + CO ↑ ③
HCOONa加热分解时,固体失重率与温度的关系如右图所示。下列说法正确的是( )

A. T<415℃时,只有反应①发生
B. 反应①、②不可能同时发生
C. 570℃<T<600℃时,残留固体的主要成分是Na2CO3
D. 残留固体中m(Na2C2O4)=m( Na2CO3)时,反应①、②的反应速率相等
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】据各地报纸报导,在一些建筑工地的食堂里,常发生将工业用盐当作食盐用,引起工人食物中毒的现象,该工业用盐对人有致癌作用。这种盐的化学式是:
A. MgCl2 B. NaCl C. NaNO2 D. NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=![]()
B. c=![]()
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.盐析可提纯蛋白质并保持其生理活性
B.油脂碱性或者酸性条件下的水解反应叫做皂化反应
C.打针时用75%的乙醇溶液消毒是蛋白质变性知识的应用
D.蛋白质、纤维素、淀粉都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: _____________________________。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①氯化钠电解槽内的阳极产物为:__________。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为:__________。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质。该反应分两步进行:第一步:NaNO2+NH4Cl===NaCl+NH4NO2 第二步:NH4NO2![]() N2↑+2H2O,下列叙述中正确的是
N2↑+2H2O,下列叙述中正确的是
①两步反应中N元素都被氧化 ②NH4Cl在反应中充当还原剂
③NaNO2在反应中充当氧化剂 ④第二步中只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
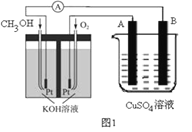
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
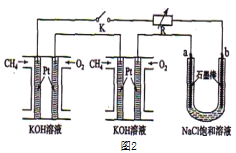
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
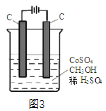
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为( NH4)2SO4。
实验测得NH4HSO3溶液中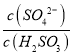 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(s) ![]() COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为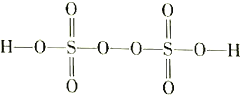 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com