
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
【答案】A
【解析】K3[Fe(CN)6]是鉴别Fe2+的试剂,遇到Fe2+会产生蓝色沉淀;滴入KSCN是鉴别Fe3+的试剂,KSCN遇Fe3+后变血红色,淀粉是鉴别I2的试剂,淀粉溶液遇I2后溶液变蓝,故A对;
向稀硫酸中加入铜片,不反应,然后通入氧气加热使铜变成氧化铜,就可以和硫酸反应了,并不能证明氧化性:稀硫酸>Cu2+,故B错;Na2SiO3溶液红色更深只能证明H2 SiO3的酸性比H2SO3弱,因H2SO3不是最高价氧化物对应得水化物,不能判断非金属性:Si<S故C错;
因为氢氧化铝是两性氢氧化物,可以溶于强碱氢氧化钠,不能证明Ksp[Al(OH)3]>K sp[Fe(OH)3],故D错。答案:A。


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.盐析可提纯蛋白质并保持其生理活性
B.油脂碱性或者酸性条件下的水解反应叫做皂化反应
C.打针时用75%的乙醇溶液消毒是蛋白质变性知识的应用
D.蛋白质、纤维素、淀粉都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是
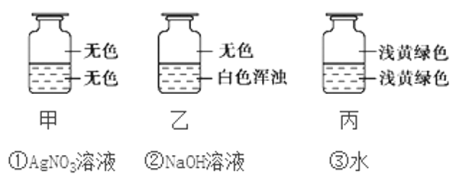
A. ②①③ B. ①②③
C. ③②① D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)键线式![]() 表示的有机物名称为__________。
表示的有机物名称为__________。
(2)A和B两种有机物可以互溶,其有关性质如表所示:
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7137 g/mL | -116.6 | 34.5 | 不溶于水 |
B | 0.7893 g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
要除去B中混有的少量A,可采用_________方法。
A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液
Ⅱ.(1)扁桃酸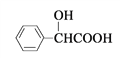 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
(2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______
III.有下列各组物质:
(A)S2和S4
(B) ![]() 和
和![]()
(C)CH4和C8H18
(D) 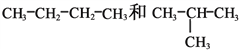
(E)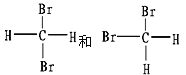
①_________组两物质互为同素异形体;
②_________组两物质互为同系物
IV.配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。
KClO3+______H2C2O4+H2SO4![]() _____ClO2↑+K2SO4+CO2↑+H2O
_____ClO2↑+K2SO4+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖.他的操作如下:取少量纯蔗糖加水配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨,在水浴中加热.实验结果没有银镜产生.其原因是( )
A.蔗糖尚未水解
B.蔗糖水解的产物中没有葡萄糖
C.加热时间不够
D.煮沸后的溶液中没有加碱,以中和作催化剂的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为( NH4)2SO4。
实验测得NH4HSO3溶液中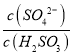 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(s) ![]() COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)=H2S(g)+ CO(s)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为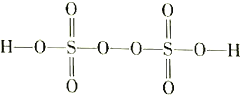 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
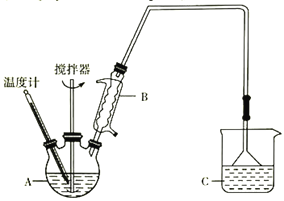
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
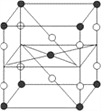
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com