
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
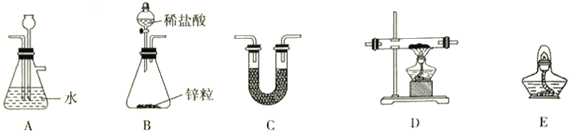
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
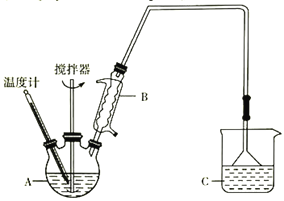
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
【答案】 还原铁粉、稀盐酸 H2+2FeCl3=2FeCl2+2HCl BACDCE或BCDCE 碱石灰 三颈烧瓶 ab C6H4Cl2 132℃ 苯 16
【解析】(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入过量的铁粉,防止Fe2+被氧化,然后保存溶液。
(2)①H2还原无水FeCl3制取FeCl2的化学方程式为:H2+2FeCl3=2FeCl2+2HCl
因为FeCl2、FeCl3易吸水按如图中装置的特点,可以知道,用H2还原无水FeCl3制取无水FeCl2,B装置一般用锌和稀盐酸制备H2,A装置用来除去氢气中的氯化氢, C装置用来干燥氢气,可以装置碱石灰, D装置中用氢气与氯化氯生成氯化亚,E装置将多余的氢气除去。据此答题; BACDCE或BCDCE 碱石灰
(3)①仪器A的名称是三颈烧瓶;装置C是防倒吸装置,所以ab具有这样的功能,故答案:三颈烧瓶 ab 。
②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,根据化合价变化规律知氧化产物是C6H4Cl2。
③三颈瓶内物质为氯化亚铁、C6H5Cl、C6H5Cl,根据表格中沸点的高低可以控制反应在132℃,对滤液进行蒸馏可。因为产品为FeCl2不溶于C6H5Cl、C6H4Cl2、苯,所以可以选择苯作为洗涤所用的试剂。答案:132℃。苯。
2FeCl3 + C6H5Cl→2FeCl2+C6H4Cl2+HCl HCl+ NaOH=NaCl+H2O
2mol 1mol 1mol
n(FeCl3)=1mol n(C6H5Cl)=2mol, C6H5Cl过量,根据关系式2FeCl3![]() NaOH氯化铁转化率达到或超过80%,需要n(NaOH)=0.4mol. m(NaOH)=16g,,答案:16g.
NaOH氯化铁转化率达到或超过80%,需要n(NaOH)=0.4mol. m(NaOH)=16g,,答案:16g.


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,11.2 L的戊烷所含的分子数为0.5 NA
B. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA
C. 1 mol甲基的电子数目为7 NA
D. 28 g乙烯所含共用电子对数目为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN。
(1)Zn2+基态核外电子排布式为_______________________。
(2)1 mol HCHO分子中含有σ键的数目为________。
(3)HOCH2CN的结构简式 ,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
,HOCH2CN分子中碳原子轨道的杂化类型分别是________和__________。
(4)与H2O分子互为等电子体的阴离子为________。
(5)下列一组微粒中键角由大到小顺序排列为_________________(用编号填写)
①CO2 ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2的燃烧热为286 kJ/mol,Li的燃烧热为299 kJ/mol。LiH可做飞船燃料,合成LiH的热化学方程式是2Li(s)+H2(g)=2LiH(s)△H=-182kJ/mol,则LiH的燃烧热为( )
A. 702 kJ/mol B. 442 kJ/mol C. 585 kJ/mol D. 351 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镍镧合金具有很强的储氢能力。
(1)用价层电子对互斥理论推测三氟化硼分子的立体构型为______,硼原子的杂化类型为_____。
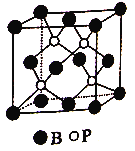
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞示意图,已知该晶胞的棱长为516pm,最近的B和P原子之间的距离为____pm。该晶体的晶体类型是________。
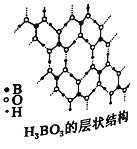
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如上图)。
①1molH3BO3的晶体中有_____mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则硼酸为_______元酸,[B(OH)4]-含有的化学键类型为_______。
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构,其中铜钙合金的结构单元如图所示。试回答下列问题:
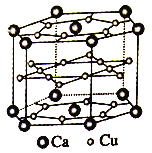
①在元素周期表中Ca位于______区。
②铜原子的基态原子核外电子排布式__________。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=_____(填数值);氢在合金中的密度为_____(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com