
【题目】硼镍镧合金具有很强的储氢能力。
(1)用价层电子对互斥理论推测三氟化硼分子的立体构型为______,硼原子的杂化类型为_____。
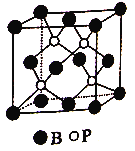
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞示意图,已知该晶胞的棱长为516pm,最近的B和P原子之间的距离为____pm。该晶体的晶体类型是________。
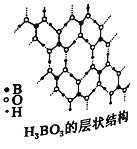
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如上图)。
①1molH3BO3的晶体中有_____mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则硼酸为_______元酸,[B(OH)4]-含有的化学键类型为_______。
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构,其中铜钙合金的结构单元如图所示。试回答下列问题:
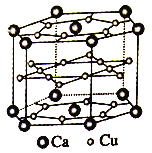
①在元素周期表中Ca位于______区。
②铜原子的基态原子核外电子排布式__________。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=_____(填数值);氢在合金中的密度为_____(保留两位有效数字)。
【答案】 平面三角形 ;sp2 223.4 pm 原子晶体 3 一 共价键、配位键 s [Ar]3d104sl 5 0.083 g/cm3
【解析】⑴ BF3中B原子形成3个δ键,孤对电子数为0.5×(3-3×1)=0, BF3中价层电子对个数=3+0.5(3-3×1)=3,且不含孤电子对,所以空间构型是平面三角形,中心原子是以sp2杂化;正确答案:平面三角形 ;sp2。
(2)根据晶胞结构图,该晶胞中含有4个P,B原子的个数为8×1/8+6×1/2=4,因此化学式为BP;根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键;已知晶胞的棱长为516pm,体对角线为516√3 pm,磷原子在体对角线上,且与B原子的距离最近为体对角线的1/4,所以最近的B和P原子之间的距离为1/4×516√3 =64.5√3= 223.4pm;正确答案:原子晶体;223.4。
(3)①硼酸分子中B与三个原子形成单键,最外层有6个电子,根据图示,1个H3BO3分子与其他3个分子能形成6个氢键,因此1 mol H3BO3的晶体中氢键为6 mol×1/2=3 mol;正确答案:3。
②硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() 离子,则硼酸能电离出一个氢原子,所以硼酸属于一元酸
离子,则硼酸能电离出一个氢原子,所以硼酸属于一元酸![]() 含有的化学键类型为共价键、配位键;正确答案:一;共价键、配位键。
含有的化学键类型为共价键、配位键;正确答案:一;共价键、配位键。
(4)①Ca位于第四周期第ⅡA族,处于s区;正确答案:s 。
②Cu的外围电子构型是3d104s1;正确答案:[Ar]3d104sl。
③铜、钙合金中,N(Cu)=12×1/2+6×1/2+6=15。N(Ca)=12×1/6+2×1/2=3,![]() =3/15=1/5,所以n=5,即LaNi5H4.5;ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为
=3/15=1/5,所以n=5,即LaNi5H4.5;ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为![]() ≈0.083 g·cm-3;正确答案:5 ;0.083。
≈0.083 g·cm-3;正确答案:5 ;0.083。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
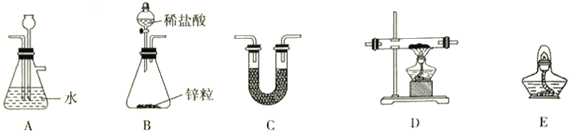
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
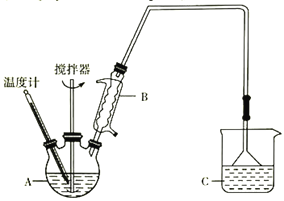
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O==2XeO3+4Xe↑ +24HF+3O2↑。下列推测正确的是( )
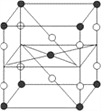
A. XeF2分子中各原子均达到八电子结构
B. 某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C. XeF4按已知方式水解,每生成4molXe,转移16mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)经过5min后,反应达到平衡,此时转移电子6mol。该反应的平衡常数为_______。V(H2)=_____mol/(L·min)。若保持体积不变,再充入2mulCO和1.5mol CH3OH,此时v(正)___ v(逆)(填“>”“<”或“=”)。
(2)在其他条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率____(填“增大”“减小”或“不变”)。
(3)下列不能说明该反应已达到平衡状态的是__________
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.V逆(CO)=2V正(H2) d.混合气体的密度不再发生改变
(4)在一定压强下,容积为VL的容器充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
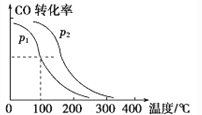
则p1_____p2(填“大于”“小于”或“等于”,下同),△H_____0。该反应在_______(填“高温”或“低温”)下能自发进行。
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离除CH3OH气体 b.适当升高温度
c.增大H2的浓度 d.选择高效催化剂
(6)下面四个选项是四位学生在学习化学反应速率与化学反应限度以后,联系化工生产实际所发表的看法,你认为不正确的是_______。
a.化学反应速率理论可指导怎样在一定时间内快出产品
b.有效碰撞理论可指导怎样提高原料的转化率
c.勒夏特列原理可指导怎样使用有限原料多出产品
d.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是 ( )

A. SiCl4是分子晶体 B. MgCl2中键的强度比NaCl中键的强度小
C. 单质R是原子晶体 D. AlCl3为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
A. 羰基硫的电子式为: :![]() :
:![]() :
:![]() :
:
B. 通入CO后,正反应速率逐渐增大
C. 再加入0.1molH2S和0.1molH2,平衡不移动
D. 反应前H2S物质的量为0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是
A.电子流从铁棒经导线流入铜棒B.溶液逐步变为浅绿色
C.溶液的酸性减弱D.气泡在铁片上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,静置,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com