
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
A. 羰基硫的电子式为: :![]() :
:![]() :
:![]() :
:
B. 通入CO后,正反应速率逐渐增大
C. 再加入0.1molH2S和0.1molH2,平衡不移动
D. 反应前H2S物质的量为0.25mol
【答案】C
【解析】A. 题给羰基硫的电子式:![]() :
:![]() :
:![]() :中碳原子没有实现8电子稳定结构,羰基硫的电子式应为:
:中碳原子没有实现8电子稳定结构,羰基硫的电子式应为: ![]() ::
::![]() ::
::![]() ,选项A错误;B. 通入CO后,正反应速率瞬间增大,又逐渐减小,选项B错误;
,选项A错误;B. 通入CO后,正反应速率瞬间增大,又逐渐减小,选项B错误;
C. 反应前CO的物质的量为1mol,平衡后CO物质的量为0.5mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
起始(mol): 1 n 0 0
变化(mol): 0.5 0.5 0.5 0.5
平衡(mol): 0.5 n-0.5 0.5 0.5
反应恰好气体分子数目不变,可以利用物质的量代替浓度计算平衡常数,则K=![]() = =1,解得n=1,再加入0.1molH2S和0.1molH2,Q=
= =1,解得n=1,再加入0.1molH2S和0.1molH2,Q=![]() =1=K,平衡不移动,选项C正确;D. 根据选项C可知,反应前H2S物质的量为1mol,选项D错误。答案选C。
=1=K,平衡不移动,选项C正确;D. 根据选项C可知,反应前H2S物质的量为1mol,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镍镧合金具有很强的储氢能力。
(1)用价层电子对互斥理论推测三氟化硼分子的立体构型为______,硼原子的杂化类型为_____。
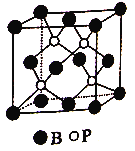
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞示意图,已知该晶胞的棱长为516pm,最近的B和P原子之间的距离为____pm。该晶体的晶体类型是________。
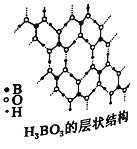
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如上图)。
①1molH3BO3的晶体中有_____mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则硼酸为_______元酸,[B(OH)4]-含有的化学键类型为_______。
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构,其中铜钙合金的结构单元如图所示。试回答下列问题:
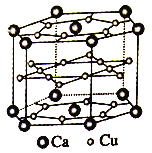
①在元素周期表中Ca位于______区。
②铜原子的基态原子核外电子排布式__________。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=_____(填数值);氢在合金中的密度为_____(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇缩甲醛有热塑性,耐磨,可以制造高强度漆包线。由A制备聚乙烯醇缩甲醛等的合成路线(部分反应条件略去)如下所示:
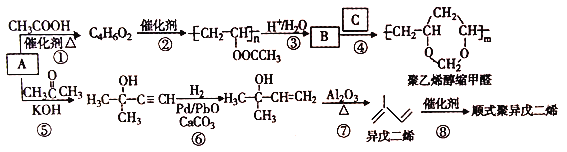
回答下列问题:
(1)A的结构简式是________,B含有的官能团名称是________;①的反应类型是______,⑦的反应类型是_________。
(2)B和C的结构简式分别为_______、_______。
(3)异戊二烯分子中最多有_____个原子共平面,顺式聚异戊二烯的结构简式为_______;写出与A具有相同官能团的异成二烯的所有同分异构体_______ (填结构简式)。
(4)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L 稀硫酸。
(1)所需浓硫酸的体积是__________。
(2)配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、________、_________。
(3)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为 ______(填序号)。
(4)第⑦步实验的操作是__________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.“偏大” b.“偏小” c.“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中_______;
B.容量瓶用蒸馏洗涤后残留有少量的水_________;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_________;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算该注射液中葡萄糖的物质的量浓度为____________ (保留两位有效数字);

(2)检查人的血液中葡萄糖(简称血糖)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L 之间。若某人的血糖检查结果为92mg/dL,他的血糖正常吗?_________ (填“正常”或“不正常”)
Ⅱ.现有0.270kg质量分数为10%的CuCl2溶液,计算
(1)溶液中CuCl2的物质的量为___________;
(2)要将溶液中的Cl-完全沉淀,需加入1.0 mol/L的AgNO3溶液_______mL;
(3)要将溶液中的铜完全置换出来,需加入Fe 的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取25.00mL KMnO4溶液,最好选用的仪器是
A. 25mL量筒 B. 25mL酸式滴定管
C. 25mL碱式滴定管 D. 有刻度的50mL烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,8 g O2含有4NA个电子
B. 1 L 0.1 mol·L-1的氨水中有0.1NA个NH4+
C. 标准状况下,22.4 L盐酸含有NA个HCl分子
D. 0.05 mol液态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com