
【题目】为了测定某有机物A的结构,设计如下实验:
①将2.3g该有机物完全燃烧,测得生成0.1molCO2和2.7g 水;
②用质谱仪测定其相对分子质量,得到如图所示的质谱图;
③用核磁共振仪处理该化合物,得到如下图所示核磁共振氢谱,图中三个峰的面积之比是1∶2∶3。
试回答下列问题:


(1)有机物A的相对分子质量是____。
(2)有机物A的实验式是____。
(3)____(填“能”或“不能”)根据A的实验式确实A的分子式,若能,说明原因___。
(4)某有机化合物A在足量的氧气中完全燃烧只生成CO2和H2O,同温同压下,其蒸气对氢气的相对密度为37。用元素分析仪分析得知,A分子中含碳、氢的质量分数分别为64.9%和13.5%,则A的分子式_______________________。
【答案】 46 C2H6O 能 实验式是C2H6O的有机物分子中,氢原子数已达到饱和 C4H10O
【解析】(1)根据质荷比可知,有机物A的相对分子质量为46;(2)2.3g有机物燃烧生成0.1mol CO2,2.7g水,则n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)=2.7g÷18g/mol=0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,则m(C)+m(H)=1.2g+0.3g=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=0.8g÷16g/mol=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,即该有机物最简式为C2H6O;(3)该有机物的最简式为C2H6O,H原子已经饱和C原子的四价结构,最简式即为分子式;(4)某有机化合物A在足量的氧气中完全燃烧只生成CO2和H2O,同温同压下,其蒸气对氢气的相对密度为37,A的相对分子质量是37×2=74。用元素分析仪分析得知,A分子中含碳、氢的质量分数分别为64.9%和13.5%,则A分子中C和H的原子个数分别是![]() 、
、![]() ,所以含有的氧原子个数是
,所以含有的氧原子个数是![]() ,因此A的分子式C4H10O。
,因此A的分子式C4H10O。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是
A.电子流从铁棒经导线流入铜棒B.溶液逐步变为浅绿色
C.溶液的酸性减弱D.气泡在铁片上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铜 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是____________________________________。
(2)属于电解质的是__________________________________________。
(3)属于非电解质的是____________________________________。
(4)②在水溶液中的电离方程式为_____________________,①与②在溶液中反应使溶液呈中性的离子方程式为_______________________。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是________。
II.当有2 mol HNO3参加反应时,被氧化的物质的质量为________g。
III.用双线桥表示该反应电子转移的方向和数目_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH,H2SO4、(NH4)2SO4
B.MgO,Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,静置,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:
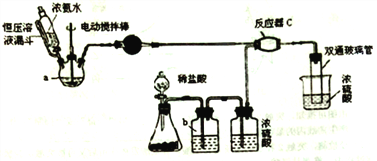
(1)写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。
(2)恒压滴液漏斗的作用是________。
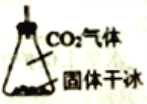
(3)有同学建议该CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种): ________ 。
(4)反应器C中发生反应的化学方程式为________ 。
(5) 双通玻璃管的作用________;b中溶液的作用________ 。
(6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1: 取少量固体样品于试管中,加入蒸馏水至固体溶解。
得到无色溶液
步骤2: 向试管中加入过量的BaCl2溶液,静置。
溶液不变浑浊,则证明固体中不含有________。
步骤3: 取步骤2的上层清液于试管中加入少量 的______。
溶液变浑浊,则证明固体中含有_______。
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学反应的产物种类与反应物的浓度、用量和反应条件均无关的是( )
A.NH3通入AlCl3溶液中
B.Cu与硝酸反应
C.CO2通入NaOH溶液中
D.Na与O2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com