
【题目】下列卤代烃发生消去后,可以得到两种烯烃的是
A. 1-氯丁烷 B. 氯乙烷
C. 2-氯丁烷 D. 2-甲基-2-溴丙烷
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 具有相同通式的有机物不一定互为同系物
B. 分子式为C3H8与C6H14的两种有机物一定互为同系物
C. 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
D. 两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。根据图示判断下列说法不正确的是
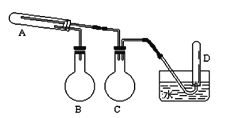
A.实验进行时试管A中应加入的试剂是普通铁粉
B.烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气
C.试管D中收集得到的是H2
D.3 mol单质Fe全部转变为Fe3O4,失去8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用反应:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O H2C2O4来探究“外界条件对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是______(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)甲同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
B | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①探究温度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
②实验a测得混合后溶液褪色的时间为40%,忽略混合前后 体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______。
(3)在其它条件相同的情况下,乙同学用不同浓度的KMnO4酸性溶液实验,测得实验数据如下表所示:
实验编号 | 温度℃ | H2C2O4溶液 | KMnO4酸性溶液 | 褪色的时间(min) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
1 | 25 | 0.10 | 4 | 0.2 | 8 | t1 |
2 | 25 | 0.010 | 4 | 0.2 | 8 | t2(t2<t3) |
依据表中数据,_____(填“能”或“不能”)得出“溶液褪色所需时间越短,反应速率越快”的结论,理由是__________________。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO42-该反应有催化作用
丙同学认为假设3不合理,其理由是__________。
②丁同学用如下实验证明假设2成立:在A和B两支试管中分别加入4mL0.2mol·L-1草酸溶液,再在A试管中加入lmL0.1mol·L-1MnSO4溶液、B试管中加入1mL蒸馏水,然后在两支试管中同时分别加入1mLO.1mol·L-1KMnO4酸性溶液,A试管溶液褪色的时间明显早于B试管。在B试管中加入1mL蒸馏水的目的是:__。
③同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. FeCl3溶液能与Cu反应,可用作铜制线路板的蚀刻剂
B. Na2SiO3易溶于水,可用作木材防火剂
C. Ca(C1O)2具有还原性,可用于消毒杀毒
D. CO2密度比空气大,可用作镁着火时的灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2+O22NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
A.缩小体积使压强增大
B.降低温度
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________________与盐酸反应最剧烈,
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理______________?并说明理由:_____________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为____________,干燥管D的作用是______________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置B、C中所装药品分别为____________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com