
【题目】某课外活动小组利用如图装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
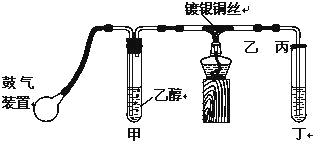
(1)甲装置常常浸在7080℃的水浴中,目的是___________
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是__________反应(填“放热”或“吸热”),该反应的化学方程式为________
(3)该小组将丁中收集到的产物继续做实验探究:
①在试管中加入2毫升10%的_____溶液,在滴加四到五滴2%的_______溶液,配制成氢氧化铜悬浊液。然后加入丁中的产物,在酒精灯上加热,可以看到_________
②写出丁种物质与新制氢氧化铜反应的化学方程式___________
【答案】使生成乙醇蒸气的速率加快 放热 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氢氧化钠 硫酸铜 有砖红色沉淀生成 CH3CHO+2Cu(OH)2
2CH3CHO+2H2O 氢氧化钠 硫酸铜 有砖红色沉淀生成 CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
【解析】
(1)乙醇易挥发,温度越高越易挥发,升高温度能促进乙醇的挥发;
(2)该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
(3)向氢氧化钠溶液中滴加少量硫酸铜溶液制取氢氧化铜悬浊液;乙醛与新制氢氧化铜反应生成乙酸、氧化亚铜、水。
(1)乙醇具有挥发性,升高温度能促进乙醇的挥发,使生成乙醇蒸气的速率加快;
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)①在试管中加入2毫升10%的氢氧化钠溶液,再滴加四到五滴2%的硫酸铜溶液,配制成氢氧化铜悬浊液。然后加入丁中的产物,在酒精灯上加热,乙醛与新制氢氧化铜反应生成乙酸、氧化亚铜、水,可以看到有砖红色沉淀生成;
②乙醛与新制氢氧化铜反应的化学方程式是CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O。
CH3COOH+Cu2O↓+2H2O。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物C10H10O2有如图的转化关系:
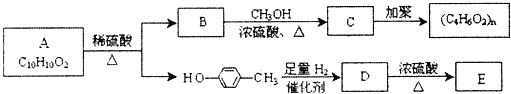
已知:E能使Br2的CCl4溶液褪色。请回答下列问题:
(1)分别写出A、C和E的结构简式:A:__;C:__;E:__。
(2)若有机物F与C互为同分异构体,则与有机物B互为同系物的F的同分异构体有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除COS,如图为天然气中脱除COS反应流化床示意图:
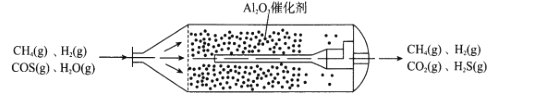
(1)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g) △H1=+6.2kJmol-1
H2S(g)+CO(g) △H1=+6.2kJmol-1
H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2=+41.2kJmol-1
H2O(g)+CO(g) △H2=+41.2kJmol-1
则COS精度脱除反应H2O(g)+COS(g)![]() H2S(g)+CO2(g)的△H=__kJmol-1。
H2S(g)+CO2(g)的△H=__kJmol-1。
②将H2O与COS以体积比1:2置于恒温恒容密闭容器中反应,若测得该反应平衡时H2O与COS的体积比1:6,则该温度下,脱除反应的平衡常数K=__(保留两位小数)。
(2)T℃时,以一定流速、不同物质的量的H2O(g)和COS(g)通过流化床,测得COS(g)脱除速率变化关系如图。
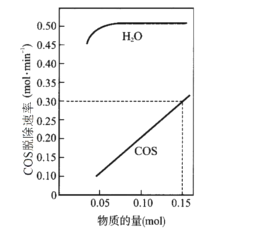
已知:COS脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若COS(g)脱除速率v=knx(COS)ny(H2O)(molmin-1),由图中的数据可算出x、k的值:x=__,k=__。
②“吸附”步骤为__(填“快反应”或“慢反应”),理由是__。
③脱除反应的决速步骤为__(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是__。
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先通电电解K4[Fe(CN)6]与KHCO3的混合溶液,通电一段时间后,再向所得溶液通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.电解过程中阴极区电极反应式为_。
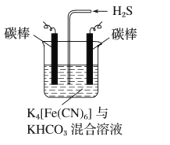
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是
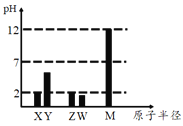
A.Z元素最高价氧化物的化学式为ZO3
B.简单离子半径大小顺序:X>M
C.简单气态氢化物的稳定性:Z>W>Y
D.X、Z的最简单气态氢化物反应有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是重要的化工原料,根据要求填写下列空格。
)是重要的化工原料,根据要求填写下列空格。
(1)苯乙烯中含官能团的名称是_________________,苯乙烯合成聚苯乙烯的化学方程式是__________________________________
(2)取10.4g苯乙烯与足量氢气反应,消耗标况下氢气的体积为___________L,生成产物的结构简式为______________,其一氯代物共有___________种。
(3)下列属于苯乙烯的性质有___________
A.能溶于水 B.能发生氧化反应
C.能发生缩聚反应 D.常温常压下为气体
(4)苯乙烯属于___________
A.环烷烃 B.不饱和烃 C.烯烃 D.芳香烃
(5)苯乙烯和氯气加成产物H,写出H与氢氧化钠溶液共热的化学方程式___________________________。其反应类型是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置,测定某种旧铝合金(含Al2O3和其它不溶于NaOH溶液的成分)中Al的质量分数,其中100mLNaOH溶液过量,每隔相同时间读得电子天平的数据如表:
称量对象 | 读数次数 | 质量(g) |
样品 | 第1次 | 2.582 |
锥形瓶+100mL NaOH溶液 | 第2次 | 185.721 |
锥形瓶+NaOH溶液+样品 | 第3次 | 188. 286 |
第4次 | 188. 254 | |
第5次 | 188. 243 | |
第6次 | 188. 243 |
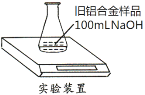
(1)反应的化学方程式为_____________________________________________________、__________________________________________________。
(2)反应中产生的H2质量为___________________ g。
(3)样品中Al的质量分数为___________________(用小数表示,小数点后保留两位)。该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
(4)取出的10mL溶液中,AlO2-的物质的量浓度为_____________________________;
(5)Al2O3的质量分数_____________________(用小数表示,小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某密闭容器中充入1.6 molH2与1.0molCO,发生如下可逆反应并达到平衡:H2(g)+CO(g)C(s)+H2O(g)+Q kJ(Q>0).若压缩容器体积并同时升高温度,达到新平衡后,关于下列物理量的变化情况叙述错误的是( )
A.反应速率可能保持不变
B.平衡常数一定减小
C.混合气体的平均摩尔质量可能减小
D.H2O(g)的体积分数可能增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com