
【题目】苯乙烯(![]() )是重要的化工原料,根据要求填写下列空格。
)是重要的化工原料,根据要求填写下列空格。
(1)苯乙烯中含官能团的名称是_________________,苯乙烯合成聚苯乙烯的化学方程式是__________________________________
(2)取10.4g苯乙烯与足量氢气反应,消耗标况下氢气的体积为___________L,生成产物的结构简式为______________,其一氯代物共有___________种。
(3)下列属于苯乙烯的性质有___________
A.能溶于水 B.能发生氧化反应
C.能发生缩聚反应 D.常温常压下为气体
(4)苯乙烯属于___________
A.环烷烃 B.不饱和烃 C.烯烃 D.芳香烃
(5)苯乙烯和氯气加成产物H,写出H与氢氧化钠溶液共热的化学方程式___________________________。其反应类型是_________________
【答案】碳碳双键 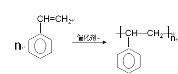 8.96
8.96 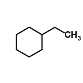 6 B BCD C6H5-CH2ClCH2Cl+2 NaOH
6 B BCD C6H5-CH2ClCH2Cl+2 NaOH ![]() C6H5-CH2OHCH2OH+2NaCl 取代
C6H5-CH2OHCH2OH+2NaCl 取代
【解析】
苯乙烯官能团为碳碳双键,属于芳香族化合物,能发生加成、加聚、取代反应。
(1)苯乙烯中含官能团的名称是碳碳双键,苯乙烯合成聚苯乙烯的化学方程式是 ;
;
(2)取10.4g苯乙烯与足量氢气反应,苯乙烯的物质的量为![]() ,即消耗氢气的物质的量为0.4mol,标况下氢气的体积为0.4mol×22.4L/mol=8.96L,生成产物的结构简式为
,即消耗氢气的物质的量为0.4mol,标况下氢气的体积为0.4mol×22.4L/mol=8.96L,生成产物的结构简式为 ,其结构中6个环境的氢原子,一氯代物共有6种。
,其结构中6个环境的氢原子,一氯代物共有6种。
(3)A.苯乙烯属于芳香烃类有机物,难溶于水,A错误;
B.有机物均能与氧气发生氧化反应,B正确;
C.苯环取代基的乙烯基是不饱和结构,能发生加聚反应,C错误;
D.苯乙烯是芳香类有机物,碳原子数高于4,在常温常压下为液体,D错误;
答案为B。
(4)苯乙烯具有碳碳双键,属于不饱和烃中烯烃,同时含有苯环,属于芳香烃。
答案为BCD。
(5)苯乙烯和氯气加成产物为C6H5-CH2ClCH2Cl,与氢氧化钠溶液共热的化学方程式C6H5-CH2ClCH2Cl+2 NaOH ![]() C6H5-CH2OHCH2OH+2NaCl,反应类型是取代。
C6H5-CH2OHCH2OH+2NaCl,反应类型是取代。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
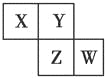
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是__。
(2)甲同学设计图1所示实验装置(夹持装置省略)制取“84”消毒液。
①B中的试剂是__。
②干燥管的作用是__。
③当C中NaOH溶液吸收完全后,停止通氯气,检验氯气已过量的方法为__。
(3)乙同学设计图2所示电解装置制取“84”消毒液。
①铁电极作__极。
②该电解制取NaClO的总反应的化学方程式为__。
③充分电解后,为检验电解液中是否还残留少量Cl-,取少量电解后溶液于试管中,滴加AgNO3溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的离子方程式为___。
④取25.00mL电解后溶液,加入过量KI与稀硫酸混合溶液,充分反应后加入2滴淀粉液,用0.1000molL-1Na2S2O3溶液滴定,消耗12.00mL。则该电解液有效氯(以有效氯元素的质量计算)的浓度为___mg/L。(已知:2S2O32-+I2═S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有:__、__(请列举出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
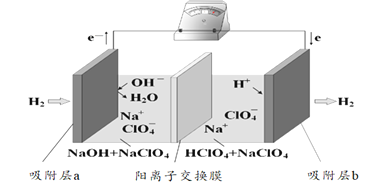
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O
C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用如图装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
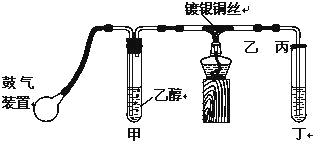
(1)甲装置常常浸在7080℃的水浴中,目的是___________
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是__________反应(填“放热”或“吸热”),该反应的化学方程式为________
(3)该小组将丁中收集到的产物继续做实验探究:
①在试管中加入2毫升10%的_____溶液,在滴加四到五滴2%的_______溶液,配制成氢氧化铜悬浊液。然后加入丁中的产物,在酒精灯上加热,可以看到_________
②写出丁种物质与新制氢氧化铜反应的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
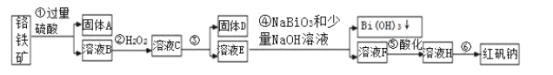
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
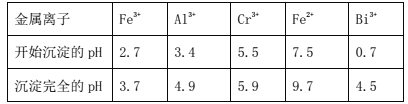
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
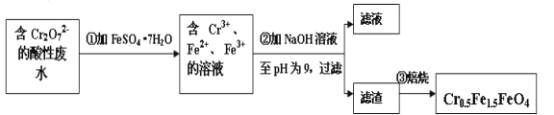
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】75号元素铼Re,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰原子价层电子的轨道表示式为__,锰处于周期表的__区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是__。
②醋酸根中C原子的杂化类型为__,1mol配离子[Cu(NH3)2]+中含有σ键的数目为__。
③写出与NH3互为等电子体的一种离子的化学式__。
(3)锰与铼处于同一族,金属铼的熔点高于锰,原因是___。
(4)三氧化铼为立方晶胞,晶胞参数为apm,三氧化铼的摩尔质量为Mg/mol;铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为__,铼原子填在了氧原子围成的空隙中___(填“四面体”“立方体”或“八面体”),三氧化铼的密度为__g/cm3。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1NaHC2O4溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图所示。下列说法错误的是( )
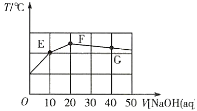
A.E点存在:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-)
B.F点存在:c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4)
C.在E、F和G点中,G点对应的Kw最小
D.G点对应的溶液中,c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com