
【题目】某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则 
(1)①反应的化学方程式为; ②0~10s内,用Z表示的化学反应速率;
③X的转化率为;
(2)已知I2(g)为紫红色,在恒容容器中,可逆反应H2(g)+I2(g)2HI(g)达到平衡的标志是( )
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.混合气体的压强不再改变.
【答案】
(1)X+Y2Z;0.08mol/(Ls);66.7%
(2)B
【解析】解答:(1)①由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.8mol:0.8mol:1.6mol=1:1:2,则反应的化学方程式为:X+Y2Z,故答案为:X+Y2Z;②v(Z)= 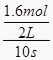 =0.08mol/(Ls),故答案为:0.08mol/(Ls);③根据图象可知参加反应的X物质的量为1.2mol﹣0.4mol=0.8mol,所以X的转化率为:
=0.08mol/(Ls),故答案为:0.08mol/(Ls);③根据图象可知参加反应的X物质的量为1.2mol﹣0.4mol=0.8mol,所以X的转化率为: ![]() ×100%=66.7%,故答案为:66.7%;(2)A、混合气体密度,未平衡时就是不变的量,故A错误;B、当反应达到平衡状态时,各物质的浓度不再变化,所以容器内气体颜色的深浅不变,故B正确;C、当体系达平衡状态时,H2、I2、HI的浓度可能相等,也可能不等,与各物质的初始浓度及转化率有关,故C错误;D、混合气体压强不再改变,未平衡时就是不变的量,容器内压强保持不变说明达平衡状态,故D错误;所以选B.分析:本题考查了根据图象写化学方程式、计算转化率、反应速率及平衡状态的判断,解题关键在于理解化学平衡状态的特征.
×100%=66.7%,故答案为:66.7%;(2)A、混合气体密度,未平衡时就是不变的量,故A错误;B、当反应达到平衡状态时,各物质的浓度不再变化,所以容器内气体颜色的深浅不变,故B正确;C、当体系达平衡状态时,H2、I2、HI的浓度可能相等,也可能不等,与各物质的初始浓度及转化率有关,故C错误;D、混合气体压强不再改变,未平衡时就是不变的量,容器内压强保持不变说明达平衡状态,故D错误;所以选B.分析:本题考查了根据图象写化学方程式、计算转化率、反应速率及平衡状态的判断,解题关键在于理解化学平衡状态的特征.


科目:高中化学 来源: 题型:
【题目】四种短周期元素X,Y,Z,W,原子序数依次增大,请结合表中信息回答下列问题.
X | Y | Z | W | |
结构 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)写出X单质的电子式 .
(2)W元素在周期表中的位置为 .
(3)Y的最高价氧化物对应水化物与Z单质反应的化学方程式 .
(4)下列可作为比较Z和Mg金属性强弱的方法是(填代号).
a.比较两种元素在化合物中化合价的高低
b.相同温度下测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
e.比较等量的两种金属与盐酸反应放气体的多少.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A.反应①的平衡常数 ![]()
B.反应③的平衡常数K= ![]()
C.对于反应③,恒容时,温度升高,H2 的浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2 的浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列叙述正确的是
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.氧化剂在同一反应中既可以是反应物,也可以是生成物
D.还原剂在反应中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号分别是和。
(2)表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。
(3)表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。
(4)请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中不正确的是
A. Na的原子失去电子能力比Mg强
B. HBr比HCl稳定
C. Ca(OH)2 的碱性比 Mg(OH)2 的碱性强
D. H2SO4 比H3PO4 酸性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com