
【题目】下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号分别是和。
(2)表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。
(3)表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。
(4)请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。
【答案】
(1))Si;Ar
(2)K;F
(3)Al;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O
(4)向NaBr溶液中通入适量Cl2后,溶液由无色变为橙红色,再向反应后的溶液中加入CCl4 , 振荡后分层,下层CCl4层呈橙红色,可证明氯气的氧化性比溴强
【解析】 (1)由⑤和⑧的位置可知⑤为Si,⑧为Ar。(2)同一周期,从左到右,元素非金属性逐渐增强;同一主族,从上到下,元素金属性逐渐增强,故最活泼的金属是⑨(即K),非金属性最强的元素是②(即F)。(4)⑦、⑩的单质分别为Cl2和Br2 , 可利用单质间的置换反应来比较两者的氧化性强弱。


科目:高中化学 来源: 题型:
【题目】下列提纯物质的方法正确的是( )
A.除去HCl溶液中的少量H2SO4 , 可加入适量Ba(NO3)2溶液后过滤
B.除去铁粉中的少量铝粉,可加入适量稀盐酸后过滤
C.除去FeCl3溶液中的少量CuCl2 , 可加入适量铁粉后过滤
D.除去Na2CO3固体中的少量NaHCO3 , 可将固体加热至恒重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向2.0L恒容密闭容器中充入1.0molPCl5 , 反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11molL﹣1 , 则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2 , 达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2 , 达到平衡时,PCl5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则 
(1)①反应的化学方程式为; ②0~10s内,用Z表示的化学反应速率;
③X的转化率为;
(2)已知I2(g)为紫红色,在恒容容器中,可逆反应H2(g)+I2(g)2HI(g)达到平衡的标志是( )
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.混合气体的压强不再改变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CO(g)+H2O(g)CO2(g)+H2(g),△H<0,在850℃,K=1,
(1)若升高到950℃,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)在850℃,若向一容积可变的密闭容器中同时充入1molCO、3molH2O、1molCO2和xmol的H2: ①当x=5时,上述平衡向(填“正反应”或“逆反应”)方向进行
②若要使上述反应开始时向正反应方向进行,则x的取值为
③当x=5mol和x=6mol,上述反应达到平衡后,H2的体积分数分别为a%和b%,则a%b%(填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)Fe(s)+CO2(g)不能自发进行,已知正反应吸热.
(l)关于化学反应方向的判据△H﹣T△S<0,反应___________(填能自发、不能自发)
答案:不能自发
(1)该反应中平衡常数的表达式 K═温度升高,化学平衡移动后达到新的平衡,平衡常数K值 . (均填增大、减小或不变)
(2)1100℃时测得高炉中 c(CO2)=0.025mol/L,c(CO)═0.lmol/L,已知1100℃时平衡常数K=0.263.在这种情况下该反应是否处于平衡状态(填是或否),此时化学反应速率是v(正)v(逆)(填=、>或<).
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO,则CO的转化率将(填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示: 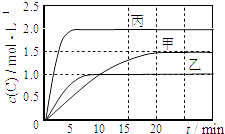
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 | 1.5molA | 1.5molA | 6.0molA |
下列说法正确的是( )
A.x=1
B.10min内乙容器中反应的平均速率v(B)=0.025molL﹣1min﹣1
C.由图可知:T1<T2 , 且该反应为吸热反应
D.T1℃,起始时甲容器中充入0.5molA,1.5molB,平衡时A的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“无论从经济的发展还是人类的进步而言,合成氨的发明都是本世纪科学领域中最辉煌的成就之一.”图1是与NH3相关的工业过程示意图. 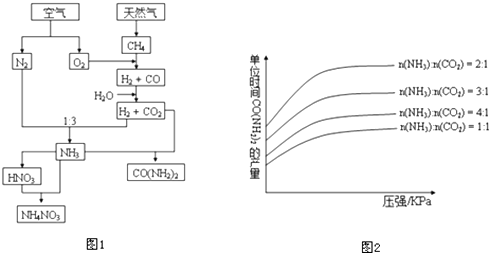
已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJmol﹣1
(1)请写出CH4(g)与O2(g)反应生成CO(g)和H2(g)的热化学反应方程式 .
(2)在生产过程中,会涉及H2和CO2的分离.你认为可取的方法是(填序号).
a.在加压条件下用水吸收CO2 b.用NaOH溶液吸收CO2 c.加压,使CO2液化
(3)合成尿素的反应是分作两步进行的:
①CO2(g)+2NH3(g)═H2NCOONH4(aq) (氨基甲酸铵)△H=﹣159.47kJmol﹣1
②H2NCOONH4(aq)═CO(NH2)2(aq)+H2O(l)△H=﹢28.49kJmol﹣1
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图2所示.生产过程中n(NH3):n(CO2)的最佳配比为 , 而实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为、 . 在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是 .
(4)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3 . 若HNO3与NH3的反应是完全的,有标准状况下50LNH3经上述反应过程生成84g NH4NO3 . 则NH3逐级转化为HNO3的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由于物质的漂白性而导致溶液褪色的是( )
①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色
②将活性炭放入红墨水中,溶液褪色
③向品红溶液中滴加氯水,红色褪去
④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去
A.①③
B.①②③
C.①②③④
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com