
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是_____。非金属性最强的元素的原子结构示意图为______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________。
(3)②③④的原子半径由大到小的顺序是_________。
(4)元素⑦的氢化物常温下和元素②的单质反应的子方程式是________。
(5)⑧的最高价氧化物对应的水化物化学式为__________。
(6)①、⑥和⑦形成的化合物的化学式为______。该化合物的化学键类型为_________。
(7)⑧⑨三种元素形成的气态氢化物最稳定的是_______。
(8)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(9)下列可以判断①和⑤金属性强弱的是_______________。
a. ①单质的熔点比⑤单质低
b. ①质软,氧化物种类比⑤多
c. ①单质与水反应,⑤单质几乎不与水反应
d. ①最高价氧化物的水化物的碱性比⑤强
【答案】Ne  KOH K>Ca>Mg 2K+2H2O=2K+ + 2OH- + H2↑ HClO4 Na2CO3 离子键,极性共价键 HF NaOH + Al(OH)3 = NaAlO2 + 2H2O cd
KOH K>Ca>Mg 2K+2H2O=2K+ + 2OH- + H2↑ HClO4 Na2CO3 离子键,极性共价键 HF NaOH + Al(OH)3 = NaAlO2 + 2H2O cd
【解析】
由元素在周期表中位置可知:①为Na元素、②为K元素、③为Mg元素、④为Ca元素、⑤为Al元素、⑥为C元素、⑦为O元素、⑧为Cl元素、⑨为Br元素、⑩为Ar元素、为F元素,结合元素周期律以及元素的性质进行答题。
由分析可知:①为Na元素、②为K元素、③为Mg元素、④为Ca元素、⑤为Al元素、⑥为C元素、⑦为O元素、⑧为Cl元素、⑨为Br元素、⑩为Ar元素、为F元素。
(1)稀有气体Ar的化学性质最不活泼,同一周期自左向右非金属性逐渐增强,同一主族自上而下非金属性逐渐减弱,所以上述元素中F的非金属性最强,其原子结构示意图为: ,故答案为:Ar,
,故答案为:Ar, 。
。
(2)①②⑤中K的金属性最强,故KOH的碱性最强,故答案为:KOH。
(3)同一周期自左向右原子半径逐渐减小,同一主族原子半径逐渐增大,所以原子半径由大到小的顺序是:K>Ca>Mg,故答案为:K>Ca>Mg。
(4)元素⑦的氢化物为H2O,该氢化物常温下和K反应生成氢氧化钾与氢气,离子方程式为:2K+2H2O=2K++2OH-+H2↑,故答案为:2K+2H2O=2K++2OH-+H2↑。
(5)⑧为Cl元素,氯元素的最高价氧化物对应的水化物为HClO4,故答案为:HClO4。
(6)①为Na元素、⑥为C元素、⑦为O元素,由Na、C、O三种元素形成的化合物为Na2CO3,Na2CO3中钠离子和碳酸根离子之间形成离子键,碳酸根中C原子与O原子之间形成极性共价键,故答案为:Na2CO3;离子键,极性共价键。
(7)⑧为Cl元素、⑨为Br元素、为F元素,同一主族元素的非金属性逐渐减弱,则F的非金属性最强,非金属性越强,形成的气态氢化物越稳定,所以⑧⑨三种元素形成的气态氢化物最稳定的是HF,故答案为:HF。
(8)①和⑤最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH+Al(OH)3=NaAlO2+2H2O。
(9)a.金属性强弱与金属单质的熔点高低没有关系,故a错误;
b.金属性强弱与硬度、氧化物种类没有关系,故b错误;
c.金属性越强,其单质越容易与水反应,①单质与水反应,⑤单质几乎不与水反应,说明钠的金属性比铝强,故c正确;
d.金属性越强,最高价氧化物的水化物的碱性越强,①最高价氧化物的水化物的碱性比⑤强,说明钠的金属性比铝强,故d正确。
故答案为:cd。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】两个单环共用一个碳原子的多环化合物称为螺环化合物,共用的碳原子称为螺原子。螺[5,5]十一烷的结构为![]() ,下列关于该化合物的说法错误的是( )
,下列关于该化合物的说法错误的是( )
A.一溴代物有三种
B.与十一碳烯互为同分异构体
C.分子中所有碳原子不可能在同一平面
D.1mo1该化合物完全燃烧需要16mo1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )

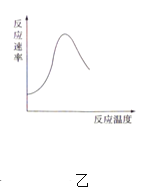


A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D. 图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
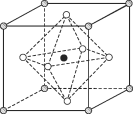
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为周期表前四周期原子序数依次增大的五种元素。其中A的基态原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,它的一种单质是天然存在硬度最大的物质;C的基态原子2p能级上的未成对电子数与A原子的相同;D和C位于同一主族,E3+ 离子3d轨道半充满。
(1)E在元素周期表的位置:______________________。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物极易溶于水,原因是_____________________。
(4)元素C与D所形成的高价化合物分子的立体构型为___________________。
(5)化合物X是元素A和C形成的三原子分子,与其互为等电子体的微粒有__________。(只写一个)
(6)从原子结构的角度解释E3+比E2+稳定的原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.CO、NO、![]() 都是大气污染气体,在空气中都能稳定存在
都是大气污染气体,在空气中都能稳定存在
B.明矾在水中生成的![]() 胶体有吸附性,因此常用明矾对水进行消毒
胶体有吸附性,因此常用明矾对水进行消毒
C.![]() 、
、![]() 或
或![]() 都会导致酸雨的形成
都会导致酸雨的形成
D.活性炭、![]() 、
、![]() 都能使品红溶液褪色,原理不同
都能使品红溶液褪色,原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种有机化合物的结构简式:
①CH3CH=CHCH2CH3②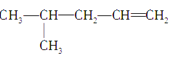 ③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥
③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥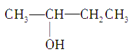 ⑦CH3CH2CH2OCH3⑧
⑦CH3CH2CH2OCH3⑧![]() ⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
(1)属于同分异构体的是______、______、__________、__________。
(2)属于官能团位置不同的同分异构体是:________、__________、________。
(3)属于官能团类型不同的同分异构体是:____、____、____、____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O(g)=H2O(l) △H=-Q1kJ·mol-1
C2H5OH(g)=C2H5OH(l) △H=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H=-O3kJ·mol-1,若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A. Q1+Q2+Q3 B. 0.5(Q1+Q2+Q3)
C. 1.5Q1-0.5Q2+0.5Q3 D. 0.5Q1-1.5Q2+0.5Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)═CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣394kJ/mol
CO(g)+![]() O2(g)═CO2(g)△H=﹣283kJ/mol
O2(g)═CO2(g)△H=﹣283kJ/mol
则CO(g)+H2O(g)![]() H2(g)+CO2(g)△H=____________.
H2(g)+CO2(g)△H=____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com