
【题目】已知A、B、C、D、E为周期表前四周期原子序数依次增大的五种元素。其中A的基态原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,它的一种单质是天然存在硬度最大的物质;C的基态原子2p能级上的未成对电子数与A原子的相同;D和C位于同一主族,E3+ 离子3d轨道半充满。
(1)E在元素周期表的位置:______________________。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物极易溶于水,原因是_____________________。
(4)元素C与D所形成的高价化合物分子的立体构型为___________________。
(5)化合物X是元素A和C形成的三原子分子,与其互为等电子体的微粒有__________。(只写一个)
(6)从原子结构的角度解释E3+比E2+稳定的原因________________________________。
【答案】第4周期Ⅷ族 N>O>C 都是极性分子相似相溶,NH3分子与水分子间存在氢键 平面正三角形 N2O Fe2+价电子排布为3d6,Fe3+价电子排布为3d5 ,Fe3+3d轨道半充满能量较低较稳定
【解析】
A、B、C、D、E为周期表前四周期原子序数依次增大的五种元素。其中A的基态原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,则电子排布式为1s22s22p2,A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,电子排布式为1s22s22p4,C为氧元素,则B为氮元素;D和C位于同一主族,D为硫元素;E3+ 离子3d轨道半充满,电子排布式为1s22s22p63s23p63d5,则E为26号元素,为铁元素。据此分析解答。
根据上述分析,A为碳元素,B为氮元素,C为氧元素,D为硫元素,E为铁元素。
(1) E为铁元素,为26号元素,在元素周期表中位于第4周期Ⅷ族,故答案为:第4周期Ⅷ族;
(2) 同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。在A、B、C三种元素中,第一电离能由大到小的顺序是N>O>C,故答案为:N>O>C;
(3) B为氮元素,B的简单气态氢化物为氨气,氨气和水分子均为极性分子,且NH3分子与水分子间存在氢键,导致极易溶于水,故答案为:都是极性分子相似相溶,NH3分子与水分子间存在氢键;
(4)元素C与D所形成的高价化合物为SO3,分子中的S原子的价层电子对数=3+![]() =3,采用sp2杂化,立体构型为平面正三角形,故答案为:平面正三角形。
=3,采用sp2杂化,立体构型为平面正三角形,故答案为:平面正三角形。
(5)化合物X是元素A和C形成的三原子分子,则X为CO2,含有3个原子,价电子数为16个,与其互为等电子体的微粒有N2O、CS2等,故答案为:N2O(或CS2);
(6)Fe2+价电子排布为3d6,Fe3+价电子排布为3d5 ,Fe3+3d轨道半充满能量较低较稳定,因此Fe3+比Fe2+稳定,故答案为:Fe2+价电子排布为3d6,Fe3+价电子排布为3d5 ,Fe3+3d轨道半充满能量较低较稳定。


科目:高中化学 来源: 题型:
【题目】PBAT(聚已二酸/对苯二甲酸丁二酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物 PBA 和PBT 共聚制得,一种合成路线如下:
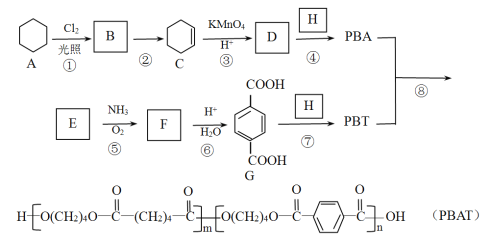
已知:R-CH3![]() R-CN
R-CN![]() R-COOH
R-COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)B 的官能团名称为_____,D 的分子式为_____。
(2)①的反应类型为_____;反应②所需的试剂和条件是_____。
(3)H 的结构简式为_____。
(4)⑤的化学方程式为_____。
(5)M 与G 互为同系物,M 的相对分子质量比G 大 14;N 是 M 的同分异构体,写出同时满足以下条件的N 的结构简式:______________(写两种,不考虑立体异构)。
Ⅰ.既能与 FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ.与 NaOH 溶液反应时,1mol N 能消耗 4molNaOH;
Ⅲ.核磁共振氢谱有五组峰,峰面积比为 1:2:2:2:1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2 和 LiMnO2 等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态 Ti 原子的价层电子排布图为____。
(2)在第四周期 d 区元素中,与 Ti 原子未成对电子数相同的元素名称________。
(3)金属钛的原子堆积方式如图所示,则金属钛晶胞俯视图为______。
![]()
(4)已知第三电离能数据:I3(Mn)=3246 kJ·mol-1,I3(Fe)=2957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是______。
(5)据报道,在 MnO2 的催化下,甲醛可被氧化成 CO2,在处理含 HCHO 的废水或空气方面有广泛应用。HCHO中键角________CO2 中键角(填“大于”“小于”或“等于”)。
(6)Co3+、Co2+能与 NH3、H2O、SCN-等配体组成配合物。
①1 mol[ Co(NH3)6]3+含______mol σ键。
②配位原子提供孤电子对与电负性有关,电负性越大,对孤电子对吸引力越大。SCN-的结构式为[S=C=N] -,SCN-与金属离子形成的配离子中配位原子是_______(填元素符号)。
(7)工业上,采用电解熔融氯化锂制备锂,钠还原 TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为 605℃、-24℃,它们的熔点相差很大,其主要原因是________。
(8)钛的化合物晶胞如图所示。

二氧化钛晶胞如图 1 所示,钛原子配位数为______。氮化钛的晶胞如图 2 所示, 图 3 是氮化钛的晶胞截面图(相邻原子两两相切)。已知:NA 是阿伏加德罗常数的值,氮化钛晶体密度为 d g·cm-3。氮化钛晶胞中 N 原子半径为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是_____。非金属性最强的元素的原子结构示意图为______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________。
(3)②③④的原子半径由大到小的顺序是_________。
(4)元素⑦的氢化物常温下和元素②的单质反应的子方程式是________。
(5)⑧的最高价氧化物对应的水化物化学式为__________。
(6)①、⑥和⑦形成的化合物的化学式为______。该化合物的化学键类型为_________。
(7)⑧⑨三种元素形成的气态氢化物最稳定的是_______。
(8)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(9)下列可以判断①和⑤金属性强弱的是_______________。
a. ①单质的熔点比⑤单质低
b. ①质软,氧化物种类比⑤多
c. ①单质与水反应,⑤单质几乎不与水反应
d. ①最高价氧化物的水化物的碱性比⑤强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是( )
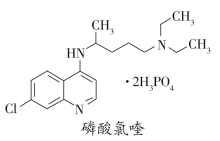
A.分子式是C18H32ClN3O8P2
B.能发生取代、加成和消去反应
C.1mol磷酸氯喹最多能与5molH2发生加成反应
D.分子中的—C1被—OH取代后的产物能与溴水作用生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的结构简式,若有违反系统命名者请予以纠正。
(1)3,5-二甲基己烷________________,正确名称:________________
(2)3,3,4,4-四甲基-2-乙基戊烷________________,正确名称:________________
(3)4,4,5,5-四甲基-3-丙基己烷________________,正确名称:________________
(4)2,3,4,5-四甲基-3-乙基-5-丙基庚烷____________,正确名称:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置适合作尾气吸收的是________(填序号)。
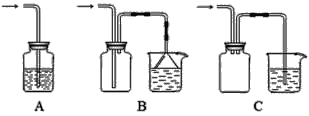
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是_____(至少填两种)如果要证明X是SO2气体,接下来的操作是______
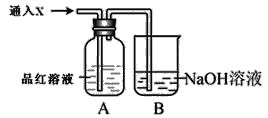
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,______后,再滴入几滴植物油;
(2)选择装置_______(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
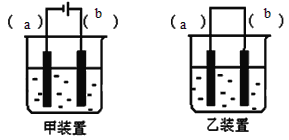
(3)在你选择的装置上标明电极材料分别为__________、________
(4)实验中可在______看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com